Bahasan tentang kimia koordinasi telah merambah di berbagai bidang keilmuan. Namun, beberapa di antaranya masih menyisakan banyak misteri. Tema kimia koordinasi tidak hanya sebatas mempelajari metode sintesis dan karakterisasi senyawa koordinasi saja, tetapi juga senyawa kompleks yang jauh lebih rumit, seperti DNA dan beberapa jenis enzim. Senyawa-senyawa tersebut sejatinya terbentuk dari ikatan kovalen koordinasi (dative covalent bond) antara atom pusat dengan ligan.
Lebih lanjut, senyawa yang lebih kompleks tersusun atas ikatan kovalen koordinasi dan gaya tambahan dari ikatan-ikatan nonkovalen (noncovalent bonds). Gaya atau interaksi tersebut dikelompokkan berdasarkan kepolaran molekul yang berinteraksi. Senyawa kompleks yang sangat ruah biasa dikenal dengan istilah-istilah khusus, seperti senyawa makromolekul, supramolekul atau metalosupramolekular.
Dalam tulisan ini, senyawa supramolekul merujuk kepada senyawa koordinasi yang sangat kompleks. Transformasi senyawa koordinasi sederhana menjadi senyawa supramolekular kadang membentuk struktur baru yang berbeda dari bentuk semulanya. Misalnya, reaksi polimerisasi pada monomer-monomer yang terkondensasi menjadi polimer dengan berat molekul besar.
Secara umum, ikatan kovalen adalah interaksi kimia yang terbentuk di antara dua atom yang saling mendonorkan elektronnya. Apabila masing-masing atom mendonorkan satu elektronnya, interaksi yang terbentuk adalah ikatan kovalen tunggal (single bond). Apabila masing-masing atom mendonorkan dua atau tiga elektronnya sekaligus, interaksi yang terbentuk adalah ikatan kovalen rangkap dua (double bond) atau rangkap tiga (triple bond).
Ikatan kovalen rangkap dua dan tiga disebut dengan ikatan kovalen tak jenuh (unsaturrated bond), seperti ikatan yang teramati pada molekul oksigen, O2 atau nitrogen, N2. Selain itu, ikatan kovalen koordinasi terbentuk apabila dua elektron atau satu pasangan elektron bebas (PEB) hanya berasal dari salah satu atom saja (free electron pair donor) dan atom pasangannya akan berperan sebagai penerima PEB (free electron pair acceptor). Baik ikatan kovalen dan kovalen koordinasi adalah interaksi yang terbentuk secara kimia dengan energi ikatan yang kuat.
Struktur kristal suatu senyawa supramolekular dapat diperoleh dari analisis difraksi sinar-X kristal tunggal atau single crystal X-ray diffraction (SCXRD). Hasil analisis struktur dapat memberikan informasi panjang dan sudut ikatan, baik ikatan kovalen maupun interaksi lemah yang terbentuk. Hasil kuantitatif dari panjang dan sudut ikatan adalah hasil rerata dari atom-atom yang memiliki posisi dan keterulangan yang sama. Pergeseran posisi atom dalam senyawa supramolekul dalam skala angstrom (10−10 meter) akan berpengaruh secara signifikan terhadap struktur keseluruhannya. Berdasarkan struktur kristal dari senyawa supramolekul dan panjang ikatan antaratom, ikatan kovalen dan jenis-jenis interaksi nonkovalen dapat ditentukan secara jelas.
Interaksi yang dapat terdeteksi oleh SCXRD adalah interaksi ionik. Fenomena tersebut teramati saat struktur dari senyawa supramolekul dan kation/anion penyeimbang berhasil ditentukan. Ikatan ionik itu sendiri adalah interaksi yang terbentuk karena interaksi antara muatan positif dan negatif. Sementara itu, interaksi antara muatan parsial positif dan negatif disebut sebagai interaksi Coulomb yang besarnya dapat diperkirakan menggunakan hukum Coulomb, F = kq1q2/r2.
Dalam hukum Coulomb, variabel F menunjukkan besar gaya Coulomb, sedangkan k adalah konstanta yang nilainya ditentukan dari dua jenis materi yang berinteraksi. Nilai k akan berbeda apabila atom-atom yang berinteraksi juga berbeda. Variabel q1 dan q2 adalah besaran kuantitatif untuk materi pertama dan kedua secara berurutan. Dalam kasus ini, interaksi ionik memiliki dua jenis muatan yang berbeda, yaitu muatan positif dan negatif. Oleh karena itu, besar F akan selalu bernilai negatif. Notasi r menyatakan jarak antara kedua materi. Menyempitnya jarak interaksi akan memperbesar gaya tolak yang berasal dari pertemuan antarmuatan negatif elektron kedua materi. Di samping itu, melebarnya jarak interaksi berpotensi untuk meniadakan gaya tarik yang terbentuk. Dengan demikian, jarak ideal di antara gaya tarikan dan tolakan adalah sebuah penentu dalam interaksi lemah ini. Informasi kuantitatif mengenai jarak tersebut dapat digunakan oleh para peneliti di bidang kristalografi untuk memprediksi jenis ikatan nonkovalen yang terbentuk.
Gaya van der Waals umum dijelaskan untuk interaksi antara molekul-molekul sederhana. Di sisi lain, interaksi serupa juga ditemukan pada senyawa supramolekul dari sisi-sisi aktif di dalam senyawa atau di antara senyawa supramolekul untuk membentuk senyawa yang jauh lebih kompleks. Gaya van der Waals antarmolekul dibagi menjadi tiga jenis berdasarkan interaksi antarmolekulnya, yaitu gaya van der Waals sebagai hasil interaksi antara molekul nonpolar dengan nonpolar, molekul nonpolar dengan polar dan molekul polar dengan polar.
Setiap jenis dari gaya van der Waals terbentuk dari fenomena yang hampir sama. Untuk interaksi antarmolekul nonpolar, interaksi yang terbentuk di antara kedua molekul tersebut adalah gaya London atau interaksi hidrofobik atau dipol sesaat. Terbentuknya gaya London ditunjukkan pada gambar di bawah ini.

Terbentuknya gaya London diinisiasi dengan terpolarisasinya molekul nonpolar (atau molekul 1) menjadi molekul bermuatan parsial positif dan negatif. Polarisasi awan elektron tersebut disebabkan oleh vibrasi tarik dan ulur asimetrik serta vibrasi tekuk atom-atom penyusun dalam molekulnya. Selanjutnya, molekul 1 yang telah terpolarisasi akan menginduksi awan elektron dari molekul 2 dan fenomena tersebut terjadi secara berulang-ulang. Interaksi antara muatan parsial positif dan negatif ini yang membentuk gaya London. Meski demikian, molekul-molekul yang telah terinduksi berpotensi kembali ke bentuk nonpolarnya dan meniadakan gaya London yang telah terbentuk sebelumnya. Di waktu yang bersamaan pula, gaya-gaya London terbentuk di antara molekul-molekul nonpolar di dalam satu sistem tersebut.
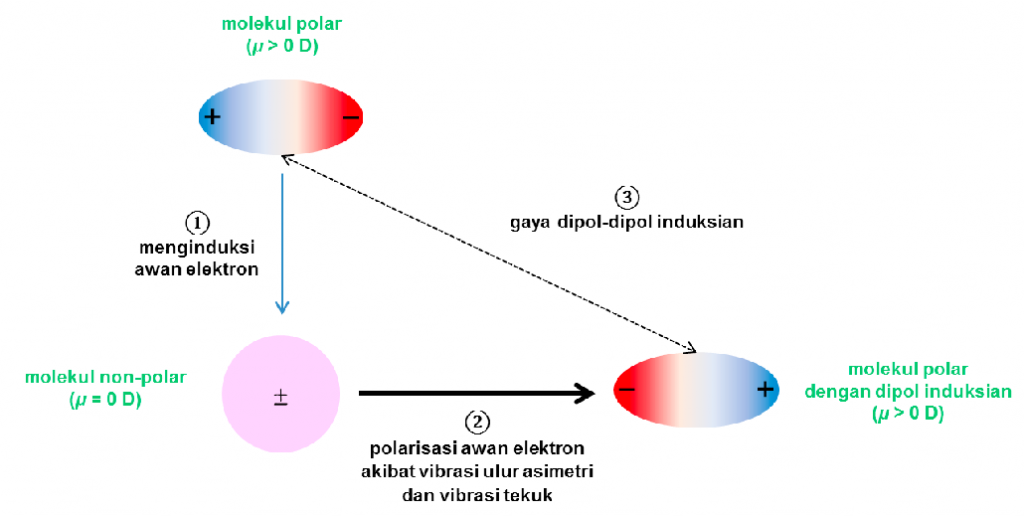
Untuk interaksi antara molekul non-polar dan polar, interaksi antara dua molekul ini disebut dengan gaya dipol-dipol induksian. Ilustrasi terbentuknya ikatan ini hampir sama dengan Gambar 1. Perbedaan dari fenomena pada Gambar 1 adalah molekul polar (atau molekul 1) akan langsung menginduksi molekul non polar (atau molekul 2) yang ditunjukkan pada Gambar 2.
Untuk interaksi antara molekul polar dengan polar, interaksi antara kedua molekul ini disebut dengan gaya dipol-dipol. Pada dasarnya, molekul polar telah dalam keadaan terpolarisasi. Pada molekul polar sederhana, apabila suatu molekul memiliki satu sisi aktif dominan bermuatan parsial negatif maka atom-atom dengan posisi terjauh dari sisi aktif tersebut akan bermuatan parsial positif dan begitu pula sebaliknya. Pernyataan sebelumnya hanyalah ilustrasi sederhana. Penentuan sisi aktif bermuatan positif atau negatif pada senyawa supramolekul tentu mempertimbangkan beberapa aspek, seperti efek induksi, resonansi dan elektronegatifitas atom. Terbentuknya gaya dipol-dipol ditunjukkan pada gambar di bawah ini.

Selanjutnya, kita bahas ikatan hidrogen. Ikatan hidrogen sejatinya hampir sama dengan gaya dipol-dipol antarolekul (gaya van der Waals). Akan tetapi, atom-atom yang berinteraksi terbatas pada atom hidrogen dan atom dengan sifat keelektronegatifan yang tinggi (X), seperti atom flor, F; oksigen, O; nitrogen, N atau belerang, S. Selain itu, atom hidrogen juga harus berikatan secara langsung dengan atom X (F, O, N atau S).
Tingkat keelektronegatifan atom dapat diukur menggunakan skala Pauli. Atom dengan skala keelektronegatifan tertinggi adalah flor (skala Pauli 4.00). Ikatan hidrogen dapat terbentuk di antara atom-atom dalam suatu molekul atau senyawa supramolekular yang disebut ikatan hidrogen intramolekul, sedangkan ikatan hidrogen yang terbentuk antara molekul-molekul atau senyawa-senyawa supramolekular disebut ikatan hidrogen intermolekul.
Pembentukan ikatan hidrogen intramolekuler atau intermolekuler tersebut dikenal juga dengan classical hydrogen bonding. Beberapa literatur menyebutkan bahwa ikatan hidrogen sangat lemah dapat terbentuk dari atom hidrogen yang berikatan kovalen dengan atom karbon (bukan atom F, O, N atau S). Fenomena ini sering dijumpai pada molekul-molekul besar, seperti enzim. Ikatan tersebut dikenal dengan istilah non-classical hydrogen bonding. Berikut illustrasi beberapa molekul sederhana yang mengadopsi classical hydrogen bonding dan non-classical hydrogen bonding.

Keterlibatan orbital π dalam suatu interaksi lemah sangat familiar ditemui pada senyawa-senyawa dengan ikatan rangkap terkonjugasi, dua di antaranya adalah gugus benzil (C6H5–) atau benzena (C6H6). Gugus benzil atau benzena memiliki muatan parsial negatif di sepanjang struktur cincin ikatan rangkap duanya. Hal tersebut karena orbital π yang terkonjugasi mendelokalisasi elektron untuk beresonansi di sepanjang ikatan rangkap dua atom karbonnya. Alasan lain adalah atom hidrogen yang berikatan dengan atom karbon terhibridisasi secara sp2 berperan sebagai gugus penarik elektron (electron widthdrawing group). Berdasarkan perilaku tersebut, gugus benzil atau benzena dapat berinteraksi dengan beberapa sisi aktif. Berikut adalah ilustrasi kemungkinan-kemungkinan interaksi orbital π benzena dengan dengan sisi-sisi aktif yang ditunjukkan pada gambar di bawah ini.

Gambar 5(a) menunjukkan interaksi π antara benzena dengan atom hidrogen yang terikat pada suatu hidrokarbon. Muatan parsial positif yang berada tepat pada atom hidrogen menginisiasi muatan parsial negatif yang berada di sekitar cincin benzena. Ikatan lemah ini sering disebut dengan CH- π interaction. Hal tersebut juga berlaku sama apabila sebuah ion logam atau kation ditempatkan pada posisi yang sama atau menggantikan posisi atom hidrogen (Gambar 5(a)).
Ilustrasi pergantian atom hidogen dengan ion logam ditunjukkan pada Gambar 5(b). Selain itu, benzena juga dapat berinteraksi dengan sebuah anion. Dalam fenomena ini, elektron pada anion dapat beresonansi dengan elektron-elektron di sepanjang cincin benzena namun tolakkan antar elektron juga menjadi suatu faktor yang patut untuk dipertimbangkan. Interaksi antara benzena dengan anion ditunjukkan pada Gambar 5(c). Selain itu, interaksi π–π dapat terbentuk antara benzena dengan turunannya; seperti heksafluoro benzena, C6F6; pada posisi sejajar. Atom flor pada senyawa heksa fluoro benzena berperan sebagai gugus penarik elektron. Dengan ditariknya awan elektron ke arah atom-atom flor, cincin benzena bertransformasi menjadi bermuatan parsial positif. Interaksi antara muatan parsial negatif pada benzena dan muatan parsial negatif pada turunannya ini menjadi posisi ideal terbentuknya interaksi π–π dengan posisi yang sejajar. Interaksi antara benzena dan fluoro benzena ditunjukkan pada Gambar 5(d).
Interaksi metalofilik adalah interaksi lemah antara logam dengan logam akan tetapi berbeda dengan ikatan logam pada umumnya. Ikatan logam adalah interaksi kimia antara atom logam yang diinisiasi oleh elektron-elektron kulit valensinya. Elektron-elektron dari suatu atom logam dapat berpindah posisi ke logam yang lain dengan syarat memiliki energi orbital yang sama. Pergerakan elektron secara berkala dan berpindah dari atom logam satu ke logam yang lain memicu terbentuknya lautan elektron. Fenomena tersebut sangat berbeda dengan interaksi metalofilik karena antara logam dengan logam tidak berikatan secara langsung.
Umumnya, ion logam berikatan dengan suatu ligan dalam senyawa makromolekul. Apabila posisi logam satu dengan logam lain mencapai jarak yang ideal maka interaksi metalofilik akan terbentuk. Konsep interaksi ini sama dengan ikatan logam namun sempitnya orbital molekul yang saling tumpang tindih menyebabkan lemahnya interaksi yang terbentuk. Interaksi metalofilik umumnya ditemukan pada senyawa makromolekul yang terbentuk dari ion logam golongan transisi, antara lain: (tembaga, Cu); (ruthenium, Ru); (rhodium, Rh); (paladium, Pd); (perak, Ag); (iridium, Ir); (platinum, Pt); (emas, Au); (air raksa, Hg); (talium, Tl); (timbal, Pb) dan (bismut, Bi). Interaksi metalofilik ditunjukkan pada gambar di bawah ini.

Pada Gambar 6, notasi ‘M’ melambangkan ion logam dan ‘L’ melambangkan atom dari ligan. Garis tidak putus merepresentasikan ikatan kovalen koordinasi, sedangkan garis putus-putus merepresentasikan ikatan metalofilik.
Interaksi-interaksi atau gaya-gaya tersebut umum ditemukan pada senyawa supramolekul. Keberadaannya akan memperkuat kestabilan kompleks senyawanya dan kerap kali menurunkan kemungkinan untuk terdisosiasi sebagai akibat dari proses solvasi. Di sisi lain, senyawa supramolekul memiliki struktur kristal yang sangat rumit seperti DNA, protein, dan enzim, oleh karena itu kristalografer tidak dapat menentukan posisi setiap atom secara akurat. Dalam kasus seperti DNA, protein, dan enzim, salah satu yang memungkinkan adalah memvisualisasikannya ke bentuk ribbon model. Kesimpulannya, pengetahuan dan pendekatan-pendekatan mengenai interaksi lemah atau non kovalen dapat berfungsi untuk mengurai kerumitan senyawa-senyawa supramolekul dan memilah-milahnya menjadi beberapa bagian kecil yang lebih sederhana untuk dipahami.
Ucapan terima kasih: Artikel ini didedikasikan untuk pernikahan Benny Wahyudianto dan Ramadhan Cendy Mega Pratiwi pada 28 Agustus 2019.
Bahan bacaan:
-
Efendy, 2007, Teori VSEPR Kepolaran, dan Gaya Antarmolekul, Edisi 3, Bayumedia Publishing, Malang Jawa Timur.
Penulis:
Benny Wahyudianto, Mahasiswa Master di Osaka University, Jepang.
Kontak: benny.wahyudianto.a(at)gmail(dot)com



