Pada Rubrik Kimia Majalah 1000guru Edisi Maret 2019, kita telah membahas aspek-aspek penting dalam senyawa single-molecular magnet (SMM), mulai dari sejarah, sisi pembahasan kuantum, hingga apa yang membuat SMM layak diperhitungkan di dalam riset kimia dan ilmu terkait di masa mendatang. Meskipun begitu, mengingat potensi aplikasinya yang signifikan dalam pengembangan komputer berkemampuan tinggi, banyak ilmuwan yang berusaha mengembangkannya dengan tidak hanya menyintesis senyawa dengan sifat SMM berbasis logam transisi atau biasa disebut logam-elektron d , tetapi juga dengan logam-elektron 4f, khususnya logam lantanoida.

Mengapa namanya “lantanoida”? Bukan “lantanida”? Ini masalah penamaan. Logam-logam di gambar di atas memang disebut “lantanida” mengingat sifat-sifatnya yang mirip dengan logam lantanamun (La). Akan tetapi, istilah “lantanida” (atau dalam bahasa Inggris ialah “lanthanide”) berpotensi rancu dengan bentuk anionik dari unsur. Unsur hidrogen dalam keadaan anionik disebut “hidrida”, unsur belerang disebut “sulfida” bila berada dalam kondisi anionik (muatan 2 minus), klorin disebut “klorida”, begitu misalnya. Kasus yang sama diterapkan pula pada logam golongan 5f sehingga disebut “aktinoida”, bukan lagi “aktinida”.
Dalam ranah riset SMM, sintesis senyawa menggunakan logam lantanoida pertama kali dilakukan oleh Ishikawa dan koleganya dalam jurnal yang terbit tahun 2003. Di sini, para peneliti tersebut menggunakan ion terbium trivalen (Tb3+) dengan ligan ftalosianin, sistem 18 elektron π. Senyawa yang disintesis berbentuk double-decker, amat mirip dengan makanan burger dengan dua molekul ftalosianin “mengapit” ion Tb(III).
Ishikawa dkk. melaporkan bahwa momen magnetisasi mengalami relaksasi pada suhu yang lebih tinggi daripada SMM dengan logam transisi. Hal ini membuat riset SMM memasuki era baru dengan melibatkan ion logam lantanoida (Woodruff dkk., 2013). Sayangnya, bahasan mengenai logam lantanoida belum banyak kita dapatkan. Oleh karena itu, sebelum kita berbicara jauh mengenai SMM berbasis ion lantanoida, ada baiknya kita berdiskusi tentang unsur-unsur golongan lantanoida terlebih dahulu.
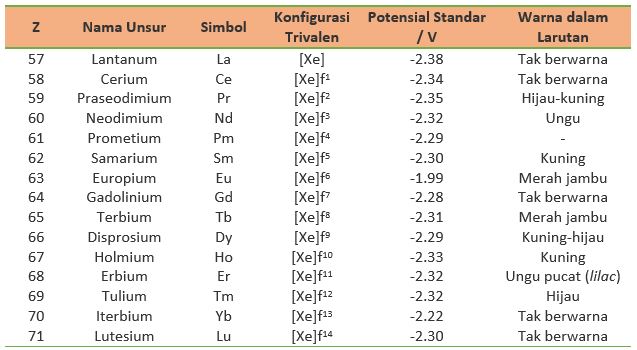
Pada dasarnya, lantanoida secara keseluruhan merupakan logam elektropositif, merujuk pada kecenderungannya untuk kehilangan electron, alih-alih mengikatnya. Dengan sifat-sifat yang relatif seragam, perbedaaan yang paling jelas dari logam-logam lantanoida adalah jejari atom atau ioniknya. Dalam kondisi yang paling stabil, kation lantanoida berada dalam keadaan trivalen dengan potensial standar Ln3+/Ln yang berkisar dari -1.99 hingga -2.38 Volt. Selain itu, dengan naiknya jumlah elektron, jari-jari ion akan berkontraksi secara berangsur-angsur dari La3+ hingga Lu3+ menjadi lebih kecil.
Secara umum, unsur-unsur logam lantanoida dapat dideskripsikan pada Tabel 1.
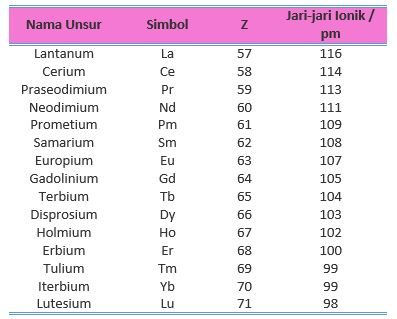
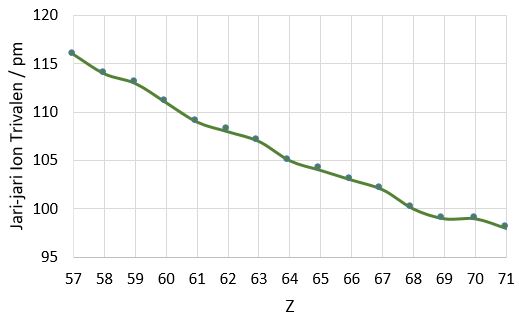
Kita bandingkan jari-jari ion trivalen lantanoida secara terpisah agar kita dapat mengamati kecenderungannya seperti ditunjukkan pada Tabel 2. Kecenderungan penurunan dapat diamati juga dengan menggunakan grafik.
Lalu, bagaimana dengan perilaku elektron di dalam sistemnya? Sayangnya, bila kita membahas perilaku elektron secara terperinci dalam artian kita mendiskusikan spektrofotometri transisi elektron 4f, kajian tersebut rumit dilakukan mengingat kemungkinan interaksi yang muncul antara elektron dari orbital f dengan elektron orbital d meski itu amat kecil. Faktor yang utama ialah bagaimana elektron tertata di dalam orbital konfigurasi tersebut. Misalnya, orbital d memiliki bilangan kuantum magnetik (ml) -2, -1, 0, 1, 2 dan orbital f memiliki ml -3, -2, -1, 0, 1, 2, 3. Tentu kita bisa menalar sendiri kemungkinan-kemungkinan elektron tertata di dalamnya dan transisi elektronik yang menyertainya.
Di sisi lain, apabila berada dalam senyawa koordinasi, interaksi antara orbital f ion pusat dengan orbital ligan relatif lemah atau kecil dikarenakan orbital f berada lebih “di dalam” lebih dekat dengan inti sehingga overlap atau tumpang-tindih yang terjadi antar orbital menjadi kurang signifikan. Walau demikian, secara visual kebanyakan ion-ion lantanoida tampak tidak berwarna karena transisi f-f yang lemah di dalamnya.
Saat berada dalam keadaan ion trivalen, apakah sifat lantanoida asam atau basa? Jawabannya, asam. Lebih tepatnya adalah asam Lewis yang kuat. Artinya, ion tersebut amat stabil ketika berikatan dengan ligan yang memiliki pasangan elektron yang siap didonorkan. Dengan kata lain, ligan adalah basanya dan tentu saja, basa Lewis dengan sifat yang kuat pula, contohnya air, oksida, sulfat, dan fosfat.
Bilangan koordinasi ion Ln3+ (simbol ion trivalen lantanoida) pada umumnya adalah 8, tapi beberapa ion lain memiliki bilangan koordinasi hingga mencapai 9 karena ukurannya yang relatif lebih besar. Walau begitu, bilangan koordinasi Ln3+ disimpulkan oleh para ilmuwan lebih dari 6.
Kalau begitu, apa yang sebaiknya kita pelajari terlebih dulu sebelum benar-benar terjun di dalam riset SMM berbasis ion lantanoida? Ada banyak tentunya, seperti struktur kristal. Hanya saja, harus diakui bahwa elektron orbital f tidak bisa dipandang secara sama persis dengan orbital d. Bagaimanapun, ada pengaruh dari inti membuat perilaku elektron f seolah-olah rumit untuk diamati bahkan dengan spektrofotometer UV-Vis biasa (panjang gelombang 400-800 nm) plus penjelasan lewat mekanika kuantum. Inilah tantangannya. Sekaligus yang membuat kimiawan terkait menjadi bersemangat.
Bahan bacaan:
- Atkins, P., Overton, T., Rourke, J., Weller, M., Armstrong, F., 2010, Shriver & Atkins’ Inorganic Chemistry, 5th, Oxford University Press.
- Woodruff N., Winpenny R.E.P., Layfield R.A., Chem. Rev., 2013, 113, 5110-5148.
- Housecroft, C.E., Sharpe, A.G., 2005, Inorganic Chemistry, 2th, Pearson Education Limited.
- Ishikawa, N., Sugita, M., Ishikawa, T., Koshihara, S., Kaizu, Y., Am. Chem. Soc., 2003, 12529, 8694-8695
Penulis:
Langit Cahya Adi, Mahasiswa S-3 di Departemen Kimia, Osaka University.
Kontak: langit.cahyadi(at)gmail.com



