Mungkin tidak banyak dari kita yang pernah bergaul dengan senyawa makrosiklik phthalocyanine (ftalosianin). Bahkan, mungkin baru kali pertama kita mendengar keberadaan senyawa ini. Bisa jadi hal ini dikarenakan oleh sifat senyawa ini yang didapatkan dengan cara sintesis dan lebih banyak digunakan sebagai pigmen pewarnaan dari warna biru pekat dari senyawa ini. Jika kita menuliskan senyawa ini dalam mesin pencari, kita akan menjumpai artikel atau hasil pencarian yang menampilkan ftalosianin sebagai senyawa untuk pigmen dan sudah banyak diproduksi secara komersial.
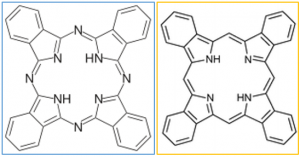
Dari segi strukturnya, senyawa ftalosianin merupakan senyawa dua dimensional yang memiliki 18 elektron π di dalam kerangkanya. Bila diamati dengan lebih cermat, ftalosianin tersusun atas empat senyawa isoindol yang saling terhubung lewat atom nitrogen. Atom yang menghubungkan subunit-subunit isoindol ini juga yang membedakan ftalosianin dari senyawa lain yang amat menyerupai dan sama-sama memiliki 18 elektron π, yaitu tetrabenzoporfirin.
Dalam senyawa tetrabenzoporfirin, empat senyawa isoindole yang menyusunnya terhubung lewat atom karbon. Perhatikan struktur tetrabenzoporfirin di bawah ini dan kita akan melihat betapa kecilnya perbedaan struktural antara tetrabenzoporfirin dengan ftalosianin.
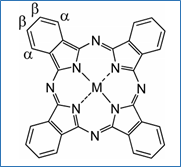
Senyawa ftalosianin memiliki bilangan oksidasi –2. Muatan negatif molekul ini terletak pada atom nitrogen yang berikatan dengan atom hidrogen sehingga disebut dalam berbagai jurnal ilmiah dengan H2Pc dan dua ion H+ dapat disubstitusi dengan ion logam (Claessens dkk., 2008; Dini dan Hanack, 2003).
Sudah disebutkan bahwa senyawa ftalosianin memiliki warna biru pekat dan pada umumnya senyawa ini digunakan untuk jadi pigmen pewarnaan. Artinya, sifat dan struktur elektronik ftalosianin memiliki aspek signifikan yang menimbulkan dampak yang sangat jelas pada sifat fisiknya. Oleh sebab itu, mari kita membahas aspek elektronis dari ftalosianin ini. Pertanyaannya, bagaimana kita mengkaji aspek elektronis senyawa ftalosianin?
Salah satu teknik yang dapat digunakan untuk mengukur sifat elektronik ftalosianin adalah dengan mengukur serapan sinar dalam rentang 300–800 nm menggunakan spektroskopi UV-Vis. Nama “UV-Vis” itu sendiri menunjukkan bahwa instrumen tersebut bekerja pada rentang panjang gelombang sinar ultraviolet yang berenergi tinggi dan panjang gelombang sinar tampak (visible light) yang berenergi lebih rendah.
Mengapa kita memilih spektroskopi UV-Vis? Tentu saja karena bentuk spektra dari serapan sinar berhubungan erat dengan struktur molekul dan struktur elektronik dari suatu senyawa itu sendiri. Dari aspek praktis atau teknisnya, penggunaan spektroskopi UV-Vis pun mudah dilakukan.
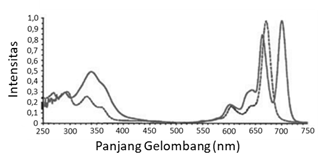
Jika kita mengukur serapan ftalosianin dalam fase larutan pada daerah sinar ultraviolet dan sinar tampak, kita akan menemukan pita serapan tinggi di wilayah dengan energi rendah di sekitar 650-700 nm yang disebut dengan Q-band dan serapan dengan intensitas jauh lebih rendah disebut B band di daerah 300–500 nm. Apa yang dinamai Q-band itulah yang jadi asal penampilan ftalosianin yang berwarna pekat (Claessens dkk., 2008; Fukuda dan Kobayashi, 2010).
Perbedaan serapan UV-vis antara H2Pc dan senyawa ftalosianin termetalkan teramati pada Q-band pada spektra. Pada H2Pc dua nitrogen dari isoindol yang ada masing-masing berikatan dengan satu hidrogen, sementara dua nitrogen dari dua isoindol lainnya bertipe nitrogen imin dengan berikatan rangkap dua dengan satu atom karbon dan berikatan tunggal dengan satu karbon di sisi lain. Dalam kondisi berikatan dengan H+, ftalosianin memiliki perbedaan arah polarisasi momen dipol elektronik, yaitu pada arah sumbu-x dan y, sedangkan perbedaan polarisasi yang seperti itu tidak ada pada ftalosianin termetalkan.
Apabila ftalosianin tersubsitusi atau berikatan dengan suatu gugus fungsi tertentu pada salah satu atom karbonnya sehingga mengakibatkan simetri molekul berkurang, pecahnya Q-band akan makin jelas tampak dan meningkat intensitasnya.
Pada dasarnya, gugus fungsi yang disubstitusikan atau yang berikatan dengan ftalosianin pun bersifat sebagai penarik elektron atau pelepas elektron. Gugus penarik elektron di antaranya adalah gugus sulfonil, karboksil, atau fluorin, sedangkan gugus pelepas elektron misalnya gugus alkoksi, amino, dan alkil.
Fungsionalisasi ftalosianin pada posisi β dengan gugus penarik elektron mengakibatkan serapan Q-band bergeser ke arah panjang gelombang yang lebih besar atau makin dekat ke daerah sinar tampak atau visible (fenomena yang biasa disebut red shift). Di sisi lain, gugus pelepas elektron tidak memengaruhi titik maksimum serapan Q-band secara signifikan. Selain itu, ekstensi atau pemanjangan sistem π dalam ftalosianin pun mengakibatkan pergeseran serupa (Claessens dkk., 2008).
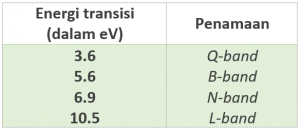
Dalam fase gas, pita serapan ftalosianin tidak hanya Q-band dan B-band saja, tetapi juga terdapat serapan tertentu yang dinamai N-band dan L-band dan keduanya memiliki energi yang lebih rendah dibandingkan Q-band dan B-band. Dini dan Hanack (2008) membahas keempat band tersebut dengan lebih rinci. Transfer muatan dari pirol (cincin segi lima dengan satu atom N) menuju cincin-cincin benzena yang sudah terkondensasi atau berikatan membuat munculnya transisi yang ditunjukkan dengan Q-band, sedangkan B-band berhubungan dengan redistribusi kerapatan elektron terkait dengan atom-atom pada azametin yang menjembatani gugus isoindol dengan gugus isoindol yang lainnya.
Keberadaan N-band terkait amat erat dengan perubahan kerapatan elektron pada atom-atom nitrogen dalam gugus pirol. Bagaimana dengan L-band? Sayangnya, L-band melibatkan berbagai macam transisi elektronik sehingga masih sulit untuk memastikan secara sungguh bagaimana mekanisme transisi elektronik yang menimbulkan keberadaannya.
Studi tentang ftalosianin dalam bentuk kristal tunggal dengan beberapa ion lantanoida pernah dilakukan oleh Kizaki dkk. pada tahun 2018. Molekul ftalosianin dicobakan untuk bersenyawa dengan tak hanya ion lantanoida trivalen, tetapi juga dengan cyclen atau 1,4,7,10-tetraazasiklododekan dan diberi kode nama [Ln(Pc)(cyclen)]+.
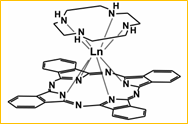
Berbicara tentang aspek spektroskopisnya, Q-band senyawa kompleks di atas muncul pada panjang gelombang sekitar 677 nm, sedangkan B-band teramati pada panjang gelombang sekitar 349 nm. Dengan bertambahnya nomor atom lantanoida, Q-band bergeser menuju daerah panjang gelombang yang lebih panjang. Artinya, transfer muatan pada rangka pirol menuju cincin-cincin benzena ternyata dipengaruhi pula oleh ion logam yang berikatan dengan nitrogen pada cincin pirol tersebut. Semakin besar nomor atom logam lantanoida, energi transisi elektronik yang diperlukan akan berkurang.
Apakah ftalosianin hanya akan berhenti pada aplikasi yang mengandalkan serapan terhadap sinar saja? Tidak, karena ftalosianin sudah diteliti aplikasinya menjadi senyawa magnetik dengan lantanoida dengan sifatnya sebagai senyawa single molecular-magnet yang menjanjikan untuk diaplikasikan pada quantum computer atau quantum computation (Ishikawa dkk., 2003).
Tentunya, jika kita bisa mempelajari lebih dalam perilaku elektron di dalamnya, yakni elektron yang ada dari lantanoida dan ftalosianin itu sendiri, kita amat mungkin menemukan fenomena lainnya yang sampai saat ini belum kita ketahui. Dengan demikian, ftalosianin sama seperti dalam sejarah perkembangan ilmu kimia, tidak hanya memiliki satu manfaat dan penggunaan saja. Ada yang tertantang?
Bahan bacaan:
- Kizaki, , Uehara, M., Fuyuhiro, A., Fukuda, T., Ishikawa, N., 2018, Synthesis of a Series of Monophthalocyaninato Cyclen Heavy Lanthanide(III) Complexes with Tetragonal Symmetry, Inorg. Chem., 57, 668−675.
- Claesens, C.G., Hahn, U., Torres, T., 2008, Phthalocyanines: From Outstanding Electronic Properties to Emerging Applications, Rec., 8, 75-97.
- Dini, D., Hanack, M., 2003, Phthalocyanines: From Outstanding Electronic Properties to Emerging Applications, dalam K.M. Kadish, K.M. Smith, R. Guilard (Ed.), The Porphyrin Handbook Volume 17 Phthalocyanine: Properties and Materials, (hal: 1-36).
- Fukuda, T., Kobayashi, N., 2010, UV-Visible Absorption Spectroscopic Properties of Phthalocyanines and Related Macrocycles, dalam K.M. Kadish, K.M. Smith, R. Guilard (Ed.), Handbook of Porphyrin Science Volume 9 Electronic Absorption Spectra–Phthalocyanines, (hal: 1-602).
Penulis:
Langit Cahya Adi, Mahasiswa S-3 di Departemen Kimia, Osaka University.
Kontak: langit.cahyadi(at)gmail.com



