Pada 7 Oktober 2019, Komite Nobel dari Karolinska Institute, Swedia menganugerahkan penghargaan Nobel dalam bidang fisiologi atau kedokteran kepada tiga orang sekaligus. Tidak jauh berbeda dari tahun sebelumnya, pemenang penghargaan Nobel kedokteran lagi-lagi diraih oleh ilmuwan yang mempunyai kepakaran dalam bidang biologi sel. Mereka adalah William G. Kaelin Jr., Sir Peter J. Ratcliffe dan Gregg L. Semenza. Ketiga ilmuwan ini dianggap telah berjasa secara independen menemukan mekanisme molekuler adaptasi sel terhadap perubahan kadar oksigen. Sebagaimana kita ketahui, penggunaan oksigen merupakan salah satu proses yang paling penting dalam menunjang kelanjutan kehidupan.

Oksigen, yang juga dikenal dengan formula O2, menyusun kurang lebih seperlima udara yang ada di bumi. Makhluk hidup, khususnya sel hewan, membutuhkan oksigen dalam proses pemecahan sari makanan menjadi energi yang diperlukan oleh tubuh. Otto Warburg sebagai pemenang hadiah Nobel kedokteran tahun 1931 menjelaskan bahwa proses tersebut melibatkan serangkaian peristiwa enzimatis di dalam organ sel yang disebut mitokondria.
Meskipun peran oksigen sangat vital bagi makhluk hidup, jumlah oksigen yang tersedia untuk sel tidaklah tetap. Sel dan jaringan senantiasa berinteraksi dengan perubahan kapasitas oksigen, misalnya pada saat pertumbuhan dan perkembangan embrio di awal kehidupan dan juga kerja otot pada jaringan yang telah dewasa. Pada kasus tertentu, jumlah ketersediaan oksigen bagi sel berubah sangat drastis seperti ketika kita berada di tempat yang sangat tinggi atau bisa juga perubahannya hanya bersifat lokal seperti munculnya luka yang menghalangi aliran darah.
Semua proses tersebut mendorong sel untuk beradaptasi dengan jumlah oksigen yang mereka miliki dengan tetap mempertahankan fungsi normalnya. Proses adaptasi ini juga dikenal dengan istilah respons hipoksia (hypoxic response). Nah, tentang bagaimana proses respons hipoksia tersebut berlangsung akan kita ulas pada tulisan berikut.
Penemuan multiprotein HIF
Jauh sebelum mekanisme detail adaptasi sel terhadap oksigen ditemukan, sebetulnya sudah ada ilmuwan yang mempelajari tentang perubahan kandungan oksigen di dalam tubuh. Corneille Heymans pada tahun 1931 menemukan bahwa badan carotid (carotid body) yang terletak di dekat pembuluh darah di kedua sisi leher, mengandung sel khusus yang mampu mendeteksi level oksigen di dalam darah. Tidak hanya itu, melalui badan karotid ini diketahui bahwa oksigen di dalam darah akan mengontrol kecepatan pernapasan dengan berkomunikasi langsung dengan sistem saraf pusat yang ada di otak.
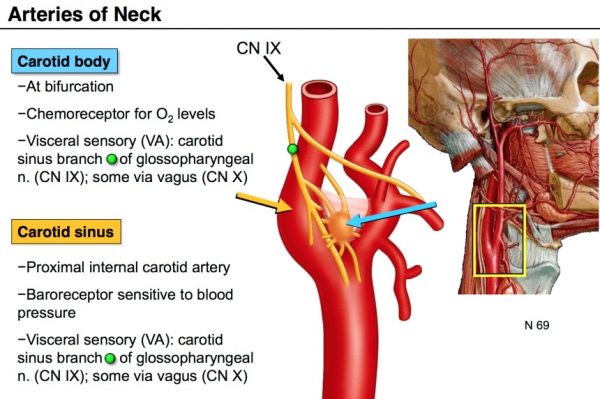
Anatomi badan karotid (carotid body) (ditunjukkan tanda panah warna biru) di dalam tubuh manusia. Sumber: liberaldictionary.com
Dalam perjalanannya, selain melalui kerja badan karotid, adaptasi oksigen ternyata diketahui berlangsung pada sistem kerja hormon eritropoietin (EPO). Seiring menurunnya jumlah oksigen atau pada kondisi hipoksia, level hormon EPO akan meningkat dan menginisiasi pembentukan sel-sel darah merah yang baru (eritropoiesis) untuk mengikat lebih banyak lagi oksigen. Peran vital hormon EPO sudah diketahui, tetapi mekanisme oksigen dalam memengaruhi proses tersebut masih menjadi misteri.
Gregg L. Semenza, profesor di Johns Hopkins University Baltimore, adalah salah satu ilmuwan yang berdedikasi mempelajari hubungan antara gen EPO dengan variasi level oksigen. Beliau menemukan bahwa segmen DNA yang berdekatan dengan segmen gen EPO terbukti memediasi respon hipoksia. Lebih jauh, Semenza berhasil mengidentifikasi kompleks protein yang berikatan dengan segmen DNA yang diidentifikasi tersebut. Menariknya, perubahan mode ikatan antara kompleks protein dengan segmen DNA yang ditemukan tadi, bergantung dengan variasi jumlah oksigen yang tersedia.
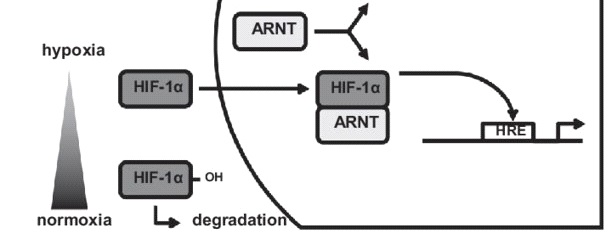
Semenza kemudian menamai kompleks proteinnya dengan sebutan hypoxia-inducible factor (HIF). Protein HIF terdiri dari dua protein yang berikatan dengan DNA, yaitu HIF-1α dan ARNT. Jumlah protein ARNT di dalam sel adalah tetap, sedangkan jumlah protein HIF-1α selalu bervariasi menyesuaikan level oksigen yang tersedia. Penemuan multiprotein HIF selanjutnya menjadi dasar yang kuat untuk menguak mekanisme adaptasi sel terhadap oksigen.
Protein VHL yang turut mengambil peran
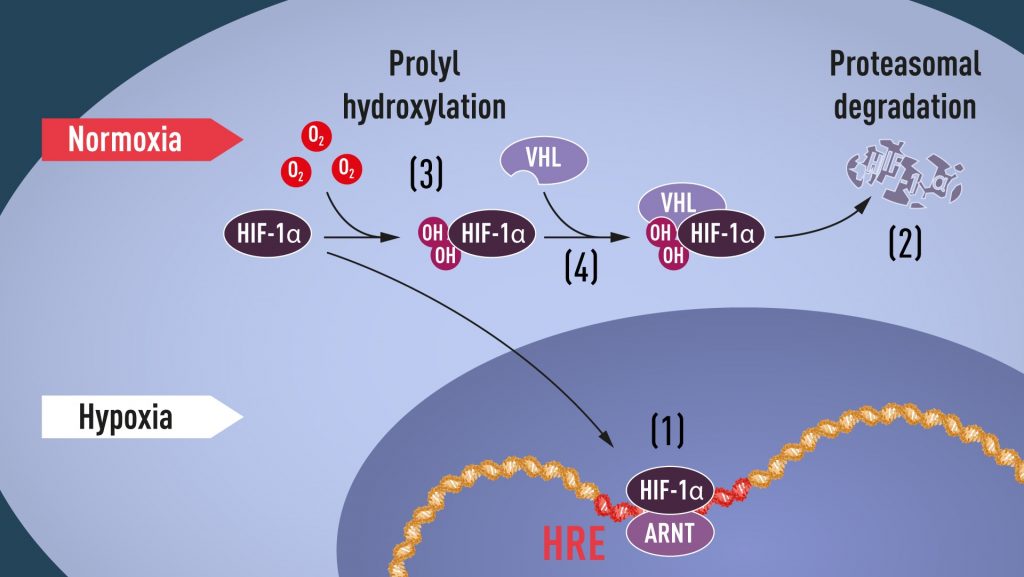
Sebagaimana dijelaskan sebelumnya, jumlah protein HIF senantiasa berubah bergantung pada jumlah oksigen yang tersedia. Ketika jumlah oksigen rendah atau pada kondisi hipoksia, jumlah protein HIF di dalam sel akan naik untuk mendorong produksi EPO. Sebaliknya, saat jumlah oksigen berada pada level normal, sel hanya mempunyai sedikit protein HIF. Berdasarkan beberapa penelitian, kondisi ini disebabkan karena pada kondisi oksigen normal, protein HIF didegradasi oleh proteasome, sejenis enzim yang tugasnya memakan protein yang tidak diperlukan di dalam sel. Proteasome dapat mendeteksi keberadaan protein HIF dengan mengenali adanya penanda yang menempel pada protein HIF itu sendiri berupa ubiquitin. Lalu, bagaimana ceritanya ubiquitin dapat menempeli protein HIF sehingga dikenali oleh proteasome?
Jawaban pertanyaan di atas datang dari William J. Kaelin, Jr., profesor ahli kanker di sekolah kedokteran Universitas Harvard Amerika. Kaelin melakukan penelitian tentang penyakit keturunan yang disebut von Hippel-Lindau (VHL). Mutasi VHL meningkatkan resiko munculnya kanker tertentu. Kaelin menemukan bahwa sel kanker yang kekurangan protein VHL memproduksi gen terkait hipoksia dalam jumlah tinggi. Sebaliknya, ketika protein VHL diinduksikan kembali ke sel kanker tersebut, jumlah gen hipoksia kembali berada dalam jumlah yang normal. Ini menunjukkan bahwa protein VHL juga mempunyai peran penting dalam mengontrol hipoksia. Hal ini selanjutnya dibuktikan oleh tim peneliti dari Universitas Oxford, Inggris yang dipimpin oleh Sir Peter J. Ratcliffe. Profesor Ratcliffe menunjukkan bahwa VHL menjadi bagian dari kompleks ubiquitin yang menjadi penanda protein HIF sehingga dapat dikenali dan didegradasi oleh proteasome pada kondisi level oksigen yang normal.
Jadi, di bagian manakah oksigen mengambil peran?
Baik Kaelin maupun Ratcliffe kemudian melanjutkan riset mereka dengan berfokus pada dua protein inti yang telah ditemukan, yakni HIF-1α dan VHL. Mereka mengemukakan bahwa pada level oksigen yang normal, gugus hidroksil akan ditambahkan pada protein HIF-1α yang kemudian menjadi jembatan menempelnya protein VHL pada HIF-1α tersebut. Menempelnya VHL pada HIF-1α menjadi semacam instruksi bagi proteasome untuk segera memakan protein HIF-1α sehingga jumlahnya menjadi sedikit pada level oksigen normal. Proses ini disebut dengan hidroksilasi gugus prolil (prolyl hydroxilation) yang berlangsung dengan bantuan enzim prolil hidroksilase. Dengan demikian, lengkap sudah jawaban misteri mekanisme adaptasi sel terhadap perubahan kadar oksigen yang ada di lingkungannya.
Penemuan Nobel 2019 pada bidang fisiologi atau kedokteran telah membuka misteri lama pelajaran biologi dasar tentang pemanfaatan oksigen sebagai ciri-ciri makhluk hidup. Penemuan ini juga menjadi pijakan penelitian lanjutan untuk penanganan berbagai macam penyakit seperti anemia dan kanker. Pengembangan obat-obatan untuk terapi anemia mulai mengambil dasar mekanisme ini dengan cara menaikkan ekspresi protein HIF sehingga diperoleh hormon EPO yang tinggi yang selanjutnya berdampak pada bertambahnya produksi sel darah merah.
Di sisi yang lain, terapi kanker dapat dilakukan dengan menekan ekpresi protein HIF pada sel kanker sehingga pembentukan jaringan darah yang baru dapat ditekan dan berpotensi menghalangi adanya suplai nutrisi bagi sel kanker tersebut. Dengan demikian, penemuan ini tidak hanya memberikan sumbangsih secara teoritis namun juga praktis bagi dunia biologi pada umumnya dan kedokteran pada khususnya.
Bahan bacaan :
- Semenza, G.L, Nejfelt, M.K., Chi, S.M. & Antonarakis, S.E. (1991). Hypoxia-inducible nuclear factors bind to an enhancer element located 3’ to the human erythropoietin gene. Proc Natl Acad Sci USA, 88, 5680-5684
- Wang, G.L., Jiang, B.-H., Rue, E.A. & Semenza, G.L. (1995). Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension. Proc Natl Acad Sci USA, 92, 5510-5514
- Maxwell, P.H., Wiesener, M.S., Chang, G.-W., Clifford, S.C., Vaux, E.C., Cockman, M.E., Wykoff, C.C., Pugh, C.W., Maher, E.R. & Ratcliffe, P.J. (1999). The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature, 399, 271-275
- Ivan, M., Kondo, K., Yang, H., Kim, W., Valiando, J., Ohh, M., Salic, A., Asara, J.M., Lane, W.S. & Kaelin Jr., W.G. (2001) HIFa targeted for VHL-mediated destruction by proline hydroxylation: Implications for O2 sensing. Science, 292, 464-468
- Jaakkola, P., Mole, D.R., Tian, Y.-M., Wilson, M.I., Gielbert, J., Gaskell, S.J., von Kriegsheim, A., Heberstreit, H.F., Mukherji, M., Schofield, C.J., Maxwell, P.H., Pugh, C.W. & Ratcliffe, P.J. (2001). Targeting of HIF-α to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation. Science, 292, 468-472
- https://www.nobelprize.org/prizes/medicine/2019/press-release/
- https://en.wikipedia.org/wiki/Carotid_body
- https://en.wikipedia.org/wiki/HIF1A
Penulis:
Wahyu Dwi Saputra, Mahasiswa S-3 di Laboratory of Nutrition, Tohoku University, Alumnus Universitas Gadjah Mada, Yogyakarta. Kontak: wahyu.dwi.s@mail.ugm.ac.id