Senyawa-senyawa koordinasi memiliki peran yang vital bagi kemajuan riset dan teknologi baik secara intra maupun interdisipliner. Pernyataan tersebut berbanding lurus dengan terpilihnya beberapa peneliti di bidang kimia koordinasi dan kristalografi dalam penghargaan-penghargaan sekelas Nobel. Saat ini, penelitian mengenai senyawa koordinasi telah merambah ke ranah pengembangan ilmu pengetahuan dan aplikasinya (senyawa fungsional).
Salah satu faktor penentu riset di ranah senyawa-senyawa koordinasi adalah instrumen-instrumen penunjangnya seperti single-crystal x-ray diffraction (SCXRD) dengan sumber sinar-X yang dihasilkan dari sinkrotron. Sinkrotron telah dimiliki beberapa negara maju dan berkembang antara lain SPring-8 di Hyogo-Jepang, Pohang Accelerator Laboratory (PAL) di Korea Selatan, dan The Deutsches Elektronen-Synchrotron (DESY) di Hamburg-Jerman.
Pada kesempatan kali ini, penulis akan membahas beberapa teori yang berkaitan erat dengan senyawa koordinasi. Tulisan ini berisi pendekatan-pendekatan dasar untuk lebih memahami artikel-artikel yang telah diterbitkan di Majalah 1000guru, seperti analisis senyawa koordinasi dalam fase padat (Majalah 1000guru Edisi ke-91) dan fase larutannya (Majalah 1000guru Edisi ke-92).
Pendekatan-pendekatan ini dibangun dari beberapa teori dasar, antara lain teori asam-basa Lewis, teori asam-basa keras-lunak, teori tolakan pasangan elektron pada kulit atom terluar (valence shell electron pair repulsion theory, VSEPR), teori geometri pada ion pusat, teori orbital molekul, dan teori hibridisasi molekul. Penulis akan memaparkan setiap teori dan pendekatanya secara garis besar disertai dengan analogi sederhana untuk memudahkan para pembaca dalam memahami keseluruhan makna.
Beberapa waktu lalu, penulis telah membahas beberapa teori dasar seperti teori asam-basa Lewis. Teori ini dikutip oleh penulis pada artikel “Filosofi Kimia Koordinasi” (Majalah 1000guru Edisi ke-61) yang menjelaskan bahwa interaksi kimia yang terbentuk dari reaksi antara ion pusat dan ligan adalah kovalen koordinasi. Berdasarkan penjelasan Gilbert N. Lewis dalam teori asam-basanya, ikatan kovalen koordinasi terbentuk dari dua buah elektron atau pasangan elektron bebas (PEB) yang berasal dari ligan (suatu nukleofil atau spesies bermuatan negatif) yang berperan sebagai basa Lewis dan didonorkan ke orbital kosong pada ion pusat yang berperan sebagai asam Lewis.
Di samping itu, senyawa-senyawa kovalen lain yang memiliki kecenderungan pada teori asam-basa keras-lunak mengindikasikan bahwa kombinasi antara ion pusat dan ligan yang memiliki tingkat kekerasan serupa akan menghasilkan interaksi baru yang stabil. Tingkat keras atau lunaknya suatu ion pusat atau ligan ditinjau dari kestabilan orbital kosong atau PEB-nya.
Kedua teori ini menjadi landasan penting untuk mengupas lebih dalam mengenai bahasan selanjutnya. Interaksi kovalen koordinasi sederhana semakin kompleks dengan keberadaan elektron yang tidak berpasangan (radikal) atau PEB di sekitar ion pusat. Fenomena ini menjadi cikal bakal dikemukakannya teori VSEPR oleh beberapa peneliti yang dapat memperkirakan panjang dan sudut ikatan secara kualitatif. Contohnya dapat kita perhatikan pada molekul air dengan rumus kimia H2O.

Sebelum sifat kepolaran air diketahui secara pasti, peneliti menduga molekul air memiliki dua buah struktur yang ditunjukkan pada gambar (a) dan (b). Hal yang perlu dicermati pada kasus ini adalah sudut ikatan H−O−H (∠HOH) dan kedua PEB dalam strukturnya. Pada gambar (a) dan (b), besar ∠HOH secara berurutan adalah 180 o dan 105o. Perbedaan sudut antara keduanya disebabkan oleh tolakan antarelektron dalam suatu PEB.
Secara harafiah, elektron memiliki muatan negatif dan pertemuan antara dua buah elektron akan menghasilkan gaya tolak. Lebih lanjut, kedua PEB yang saling berdampingan akan menghasilkan gaya tolak yang lebih besar dibandingkan dengan tolakan antarelektron dalam satu PEB. Pendekatan tersebut adalah sebuah penjelasan mengenai struktur air pada gambar (b). Penyempitan ∠HOH pada gambar (b) akan diimbangi dengan bertambahnya panjang ikatan O−H. Tujuannya untuk menstabilkan tolakan antaratom hidrogen atau antar ikatan kovalen koordinasi yang telah terbentuk antara atom oksigen dan hidrogen yang biasa disebut dengan pasangan elektron ikatan (PEI).
Analogi untuk lebih memahami pengaruh dari PEB diilustrasikan dengan kejadian beberapa penumpang dalam sebuah metromini. Misalnya, metromini harus menampung 10 orang penumpang dalam sekali jalan. Ternyata, sebanyak 9 orang penumpang memiliki ukuran badan normal dan 1 orang penumpang memiliki badan yang sangat besar (disumsikan 3 kali lebih besar dari penumpang berukuran normal). Penumpang berbadan besar inilah yang diibaratkan sebagai PEB.
Sesuai dengan illutrasi di atas, setelah 1 penumpang berbadan besar tersebut masuk ke dalam metromini, 9 penumpang lainnya akan saling merapatkan posisi duduknya secara spontan. Bahkan, 9 penumpang berbadan normal akan menekuk kaki-kakinya agar semua penumpang muat di dalamnya. Merapatnya penumpang merupakan suatu respons yang bertujuan untuk menstabilkan interaksi di antara penumpang yang satu dengan yang lain. Kondisi tersebut sama halnya dengan perubahan sudut dan panjang ikatan pada struktur molekul air yang telah dijelaskan pada paragraf sebelumnya.
Suatu struktur kimia dikatakan stabil apabila interaksi antaratomnya maksimum dengan energi tolakan antaratomnya yang minimum. Inilah filosofi kimia yang dijadikan pedoman untuk mengatakan suatu interaksi atau senyawa dapat dikatakan stabil atau tidak.
Pendekatan lain mengenai struktur molekul pada ion pusat biasa dijelaskan dengan teori geometri. Teori ini memberikan informasi mengenai posisi ligan-ligan saat berinteraksi dengan ion pusat. Posisi tersebut ditentukan oleh banyaknya ligan dan PEB di sekitar ion pusat. Analogi dari interaksi ini akan dijelaskan sebagai berikut. Misalnya, dua orang yang saling bermusuhan ditempatkan dalam suatu lapangan berbentuk persegi yang terisolasi di sekelilingnya. Berdasarkan illustrasi ini, di manakah posisi setiap orang dalam lapangan tersebut? Jawaban dari pertanyaan ini adalah jarak terjauh di antara mereka atau berada di ujung-ujung diagonal lapangan apabila keduanya menghendaki keadaan yang paling stabil.
Apabila ditarik garis lurus, kedua orang itu akan membentuk garis linier dengan sudut sebesar 180°. Fenomena tersebut sama halnya yang terjadi dengan ion pusat. Ion pusat akan membentuk geometri tertentu dengan ligan agar membentuk interaksi yang paling stabil. Banyaknya ligan yang berikatan dengan ion pusat dinyatakan sebagai bilangan koordinasi (BK). Di sisi lain, keberadaan PEB di sekitar ion pusat menyebabkan beberapa transformasi pada bentuk geometrinya, yang juga dikenal dengan distorsi.
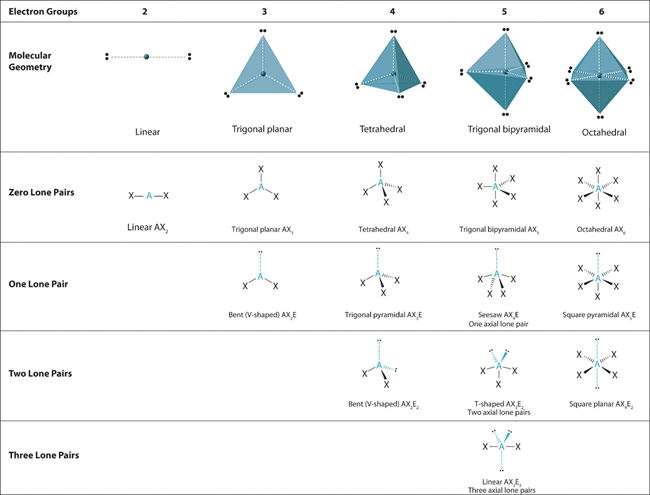
Pada gambar di atas, notasi ‘X’ mewakili ligan dan notasi ‘••’ mewakili PEB. Berdasarkan gambar tersebut, seorang kimiawan dimudahkan dalam memperkirakan bentuk geometri yang akan terbentuk di sekitar ion pusat sebelum mereka mereaksikan reagen di laboratorium.
Setelah senyawa koordinasi yang diharapkan telah terbentuk, pertanyaan selanjutnya adalah bagaimana tingkatan bentuk diagram orbital molekulnya? Diagram tersebut memiliki kekerabatan yang sangat dekat dengan bentuk geometri pada ion pusat, tetapi penentuan diagramnya akan sedikit bertambah rumit dengan fenomena hibridisasi ion pusat yang terjadi sebagai suatu respons terhadap ligan-ligan yang mendekat.
Kita telah singgung sedikit tentang ion logam (asam Lewis) yang berperan dalam menyediakan orbital kosong yang kemudian diisi oleh PEB dari ligan (basa Lewis). Senyawa koordinasi dengan BK tinggi biasanya dimiliki oleh ion atau logam yang memiliki orbital d kosong pada konfigurasinya. Pada kasus ini, ion atau atom logam yang berasal dari golongan transisi, lantanida, dan aktinida.
Diagram orbital molekul yang akan dipaparkan dalam tulisan ini adalah dari konfigurasi yang paling sederhana yaitu diagram orbital molekul dari ion logam. Misalnya, ion ferri atau Fe3+ berinteraksi dengan 6 buah ligan X− dengan geometri ion pusat oktahedral (BK 6). Senyawa koordinasi yang terbentuk adalah AX6 atau lebih spesifiknya [FeX6]3−. Konfigurasi elektron ion Fe3+ adalah 26Fe3+: (1s)2 (2s)2 (2p)6 (3s)2 (3p)6 (3d)5 (4s)0
Berdasarkan konfigurasi elektron Fe3+, elektron valensi berada di kulit ketiga atau kulit M yang berisi (3s)2 (3p)6 (3d)5. Jika senyawa [FeX6]3− memiliki bentuk oktahedral, ligan-ligan diasumsikan akan berinteraksi tepat pada sumbu x, y, dan z baik pada arah positif maupun arah negatifnya.
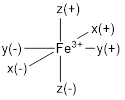

Berdasarkan gambar di atas, perbedaan antara orbital s dan p dengan orbital d adalah semua orbital s dan p berada tepat pada sumbu x, y, maupun z, sedangkan beberapa orbital d tidak tepat pada sumbu-sumbu tersebut. Beberapa orbital d yang tidak tepat pada sumbu yaitu orbital dxy; dxz; dan dyz. Efek dari tepat atau tidaknya suatu orbital pada sumbu akan teramati ketika ligan berinteraksi dengan ion pusat yang tersusun dari orbital s, p, dan d. Berdasarkan gambar, orbital pz memiliki dua cuping yang tepat pada sumbu z. Kedua cuping masing-masing berwarna merah dan biru yang dianalogikan sebagai fase negatif dan positif orbital Pz. Kemudian, suatu ligan berfase negatif diasumsikan mendekati selanjutnya berinteraksi dengan orbital Pz. Interaksi antara fase negatif dari orbital Pz dan ligan menyebabkan fase negatif dari orbital Pz tersebut mengalami peningkatan energi. Hal tersebut disebabkan oleh tolakkan antara elektron-elektronnya.
Pertama, definisi dari orbital adalah probabilitas tertinggi ditemukannya elektron. Kedua, ligan tersebut akan mendonorkan PEB yang dimilikinya. Kesimpulannya, energi untuk menstabilkan tolakkan antar elektron tersebut haruslah lebih tinggi. Di sisi yang lain, fase positif dari orbital Pz akan mengalami penurunan energi interaksi terjadi. Orbital yang mengalami kenaikan energi disebut dengan orbital anti ikatan (anti bonding orbital) sedangkan orbital yang mengalami penurunan energi disebut dengan orbital ikatan (bonding orbital).
Fenomena pemecahan suatu orbital menjadi orbital ikatan dan antiikatannya disebut dengan pemecahan tingkat energi (energy level splitting). Pemecahan tingkat energi pada geometri oktahedral terjadi pada orbital dx2-y2 dan dz2. Akan tetapi, orbital dxy; dxz; dan dyz tidak mengalami pemecahan tingkat energi karena orbitanya tidak berada tepat pada sumbu-sumbu x, y, maupun z. Dengan kata lain, ketiga orbital tidak langsung berhadapan dengan ligan. Dari penjelasan tersebut, keseluruhan orbital s dan p akan mengalami pemecahan tingkat energi sedangkan kelima orbital d akan terbagi menjadi dua kelompok yaitu orbital yang berada tepat pada sumbu (orbital eg) dan orbital yang tidak berada pada sumbu (orbital t2g).
Dalam kimia koordinasi, pemecahan tingkat energi lebih difokuskan pada orbital d. Orbital d akan aktif mengalami pemecahan level energi saat berinteraksi dengan ligan. Pemecahan orbital d dan orbital lainnya ditunjukkan pada gambar.
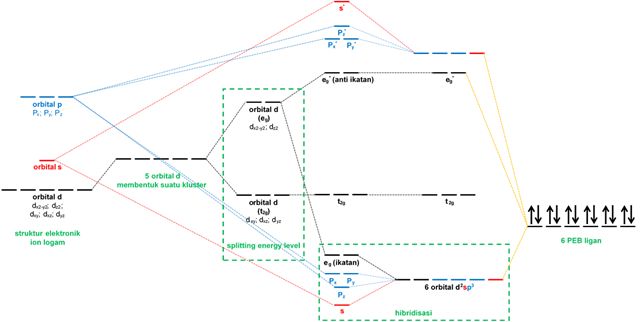
Berdasarkan diagram, orbital eg akan mengalami pemecahan lebih lanjut menjadi orbital eg ikatan dan anti ikatannya. Penjelasan mengenai fenomena ini sama dengan pada analogi orbital Pz sebelumnya. Pemecahan tingkat energi tidak hanya terjadi pada orbital d saja (atau orbital 3d pada kasus ion Fe3+) tetapi orbital 4s dan 4p yang belum terisi oleh elektron.
Pemecahan orbital 4s analog dengan penjelasan sebelumnya, yakni membentuk orbital s ikatan dan antiikatannya. Begitu pula dengan orbital p akan tetapi orbital Pz memiliki energi orbital ikatan yang lebih rendah dan energi orbital antiikatan yang lebih tinggi dibandingkan dengan kedua orbital p yang lain. Hal tersebut dijelaskan oleh asumsi bahwa sumbu z memiliki posisi yang sangat terbuka dibandingkan dengan sumbu x dan y. Berdasarkan asumsi tersebut, suatu ligan seolah-olah akan lebih mudah untuk berinteraksi dengan sumbu Pz terlebih dahulu karena energi yang dibutuhkan jauh lebih rendah.
Fenomena yang terjadi saat tepat ligan akan menginduksi ion pusat dikenal dengan hibridisasi. Hibridisasi dalam senyawa koordinasi ini sangat jarang dijelaskan secara mendetail oleh beberapa pengarang buku kimia dasar atau buku kimia anorganik. Fenomena hibridisari pada ion Fe3+ (low spin) melibatkan dua orbital 3d dalam (inner d orbital), satu orbital 4s, dan tiga orbital 4p yang telah disesuaikan sedemikian rupa dengan diagram orbital.
Proses hibridisasi dibutuhkan untuk menyejajarkan tingkat energi dari gabungan orbital-orbital dengan tingkat energi yang berbeda-beda. Dengan demikian, ligan dapat berikatan dengan ion pusat pada tingkat energi yang sama. Enam orbital dengan tingkat energi berbeda akan berhibridisasi dan menghasilkan enam orbital molekul d2sp3 baru dengan tingkat energi setara dan lebih rendah dari tingkat energi beberapa orbital sebelumnya. Peristiwa selanjutnya, keenam orbital ligan yang masing-masing memiliki PEB akan berinteraksi dengan orbital yang telah terhibridisasi sehingga prakiraan diagram orbital senyawa molekul AX6 atau [FeX6]3− telah terjawab.
Pengukuran secara kuantitatif dapat menggunakan bantuan superkomputer dengan perangkat lunak Gaussian atau sejenisnya. Metode dan tingkat keakuratannya pun beragam, misalnya metode semiempiris atau ab initio. Prinsip dari perhitungan kuantitatif ini yaitu menghitung energi penstabilan dari interaksi setiap elektron dalam suatu atom ditambah dengan interaksi setiap elektron dalam suatu atom dengan setiap elektron dalam atom yang lain.
Kestabilan senyawa koordinasi dapat dihitung dengan perhitungan sederhana yang dikenal dengan energi penstabilan medan kristal (crystal field stabilization energy, CFSE). Beberapa referensi juga memberikan perhitungan mengenai energi penstabilan medan ligan (ligand field stabilization energy, LFSE). Perbedaan antara CFSE dan LFSE adalah pengaruh tanpa dan dengan keberadaan ligan, misalnya ion Fe3+ untuk istilah CFSE dan ion [FeX6]3− untuk istilah LFSE dengan X adalah ligan. Namun, formula atau rumus dari CFSE dan LFSE tetap sama. Formula CFSE atau LFSE untuk geometri oktahedral adalah
![]()
Informasi yang dibutuhkan untuk menghitung nilai tersebut adalah jumlah elektron pada orbital t2g dan eg. Konstanta −0,4 dan 0.6 diperoleh dari perhitungan komputasi yang telah dijelaskan pada paragraf sebelumnya. Besarnya nilai CFSE atau LFSE diukur dengan satuan Δo (dibaca delta oktahedral). Satuan lain yang kerap kali digunakan adalah Dq. 1 Δo setara dengan 10 Dq. Nilai 10 Dq pada geometri oktahedral diperoleh dari besarnya energi yang dibutuhkan oleh satu elektron untuk tereksitasi dari orbital t2g menuju ke orbital eg. Setelah nilai Δo atau 10 Dq diperoleh, besaran Δo atau Dq tersebut dapat disubstitusi dengan suatu besaran lain yang bersatuan bilangan gelombang (cm-1). Besarnya Δo atau Dq pada setiap senyawa koordinasi tentu berbeda-beda.
Nilai negatif pada CFSE atau LFSE mengindikasikan bahwa senyawa kompleks tersebut sangatlah stabil. Definisi dari stabil adalah ion logam dan ligan yang bereaksi hanya butuh melepaskan sejumlah energi untuk membentuk senyawa koordinasi baru dan biasanya reaksi berlangsung pada suhu ruang dan spontan. Sebaliknya, nilai positif pada CFSE atau LFSE mengindikasikan bahwa senyawa tersebut lebih tidak stabil dari pernyataan sebelumnya. Perhitungan ini biasa digunakan untuk memperhitungkan reaksi pergantian ligan pada senyawa-senyawa koordinasi sederhana yang mematuhi deret spektrokimia atau deret kekuatan ligan dan sering dikenal dengan spectrochemical series. Perhitungan CFSE atau LFSE ini juga memperhitungkan jenis medan kristal atau jenis konfigurasi spin elektron orbital d-nya.
Setelah memahami diagram orbital molekul senyawa kompleks sederhana, penjelasan tentang transisi elektron pada senyawa koordinasi akan lebih mudah untuk diimajinasikan. Senyawa koordinasi memiliki 4 jenis transisi elektron. Jenis pertama adalah transisi elektron dari orbital d (t2g) menuju ke orbital d (eg) atau dikenal dengan d-d electron transition. Kedua, transisi elektron dari orbital ikatan ligan ke orbital d pada ion pusat atau dikenal sebagai ligand-to-metal charge transfer (LMCT). Transisi ini serupa dengan reaksi oksidasi karena jumlah elektron dan bilangan oksidasi pada ion pusat akan bertambah. Ketiga, transisi elektron yang berkebalikan dengan LMCT yaitu perpindahan elektron dari orbital d ion logam menuju ke orbital antiikatan pada ligan atau yang dikenal dengan sebutan metal-to-ligand charge transfer (MLCT). Orbital antiikatan ligan ini diasumsikan sebagai orbital Px*; Py*, Pz*; atau S* pada diagram orbital. Perpindahan elektron menyebabkan ion pusat mengalami pengurangan elektron serupa reaksi reduksi pada fenomena perubahan sifat kimia. Transisi terakhir adalah perpindahan elektron dari orbital ikatan ligan menuju ke orbital anti ikatan ligan atau dikenal dengan sebutan ligand-to-ligand charge transfer (LLCT). LLCT terjadi saat ligan mengalami pemutusan suatu ikatan, misalnya dari ikatan rangkap menjadi ikatan tunggal dalam struktur ligan itu sendiri.
Fenomena-fenomena di atas hanya menjelaskan pada senyawa-senyawa koordinasi dengan ion pusat bergeometri oktahedral (BK 6). Bagaimana dengan geometri lainnya? Geometri bujur sangkar dapat dianalogikan sebagai geometri oktahedral dengan 2 ligan pada posisi sumbu z(+) dan z(−) yang ditarik hingga jarak tak terhingga atau dengan kata lain ‘dihilangkan’. Berdasarkan asumsi tersebut, ligan tidak akan berinteraksi dengan sumbu z. Selanjutnya, orbital d pada ion logam yang mengandung unsur z akan mengalami penurunan tingkat energi karena orbital-orbital tersebut tidak akan bertemu dengan PEB dari ligan-ligan. Penurunan energi ini bertujuan untuk memperoleh tingkat energi baru yang lebih stabil (sama dengan analogi penumpang dalam metromini sebelumnya). Pemecahan tingkat energi orbital d untuk geometri bujur sangkar ditunjukkan pada gambar transformasi diagram orbital.
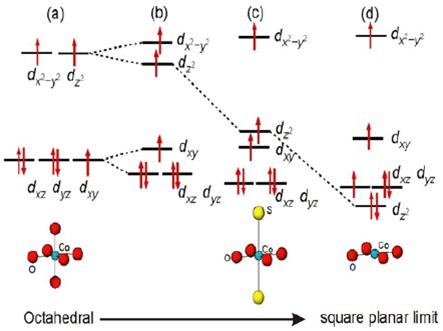
Bentuk geometri berperan penting dalam penentuan struktur dan beberapa faktor kuantitatif pada senyawa koordinasi. Jika bentuk geometri pada ion pusat berbeda maka perhitungan nilai CFSE atau LFSE-nya juga berbeda. Hal tersebut terjadi akibat perubahan konstantanya. Berikut beberapa contoh diagram orbital molekul dari berbagai macam geometri ion pusat.

Ucapan terima kasih:
Penulis mendedikasikan artikel ini kepada Bapak Efendy, Bapak Abdul Ghofir, Ibu Prayuwati, Ibu Kus, dan Ibu Indri selaku guru kimia penulis.
Bahan bacaan:
- Efendy, 2007, Teori VSEPR Kepolaran, dan Gaya Antarmolekul, Edisi 3, Bayumedia Publishing, Malang Jawa Timur.
- Efendy, 2011, Perspektif Baru Kimia Koordinasi, Edisi 2, Jilid 1, AIP Publishing, Malang Jawa Timur.
Penulis:
Benny Wahyudianto, Mahasiswa Master di Osaka University, Jepang.
Kontak: benny(dot)wahyudianto(dot)a(at)gmail(dot)com.