Senyawa koordinasi kerap kali dihubungkan dengan kristal dan strukturnya. Seorang ahli kristolagrafi dapat menganalisis struktur senyawa koordinasi dari berkas-berkas difraksi atom-atom dalam sebongkah kristal. Setelah struktur senyawa pada kristal dianalisis, seluruh ikatan kimia dapat ditentukan dan dibedakan menggunakan informasi panjang ikatan kuantitatif antara dua atom. Struktur-struktur kristal diperoleh dari kombinasi berbagai jenis ion atau atom pusat dan ligan yang berbeda-beda. Oleh karena itu, klasifikasi atau nomenklatur struktur kristal sangat diperlukan untuk membedakan jenis satu struktur dengan yang lain.
Perlu dicermati bahwa suatu kristal tidak tersusun dalam keadaan 100% sempurna (ordered part). Beberapa bagian terkadang tidak sama dengan struktur yang semestinya (disordered part). Fenomena ini dinamakan cacat kristal (crystal defect). Cacat kristal kadang kala dianggap sebagai fenomena yang unik, tetapi bukan berarti bahwa struktur kristal tersusun dengan tidak beraturan. Fenomena keunikan senyawa koordinasi tidak hanya dianalisis dalam fase padat saja, tetapi juga dalam fase larutan.
Analisis dalam fase larutan mutlak diperlukan karena struktur kristal mungkin mengalami perubahan saat diberikan perlakuan tertentu. Misalnya, senyawa koordinasi dengan ion pusat M+ dapat teroksidasi menjadi M2+ saat bereaksi dengan suatu oksidator. Berubahnya bilangan oksidasi ion pusat menyebabkan ikatan antara atom pusat dan atom ligan yang berikatan langsung mengalami pemendekan. Dengan kata lain, struktur kristal akan kembali bertransformasi untuk mencapai tingkat kestabilan yang baru ketika strukturnya berubah.
Perubahan struktur kristal senyawa koordinasi dapat diikuti dengan fenomena tertentu dan salah satunya adalah perubahan warna. Fenomena perubahan warna pada senyawa koordinasi ini memiliki potensi dan banyak diaplikasikan sebagai bahan baku pembuatan material sensor. Berdasarkan dua alasan di atas, penulis ingin kembali menegaskan bahwa analisis senyawa koordinasi dalam fase larutannya bertujuan untuk melengkapi karakterisasi fase padat (kristal) yang telah dijabarkan oleh penulis pada artikel Majalah 1000guru Edisi ke-91.
Pepatah mengatakan bahwa tidak ada sesuatu yang sempurna. Begitu juga dengan analisis pada fase larutan. Terlarutnya suatu kristal pada pelarut yang sesuai kadang kala menyebabkan perubahan struktur kristal dan berbeda dari fase padatnya. Meski demikian, tidak semua kristal mengalami fenomena tersebut. Pada artikel ini, penulis akan memaparkan beberapa instrumen yang relevan dengan analisis senyawa-senyawa koordinasi. Instrumen-instrumen tersebut antara lain spektrofotometer ultraviolet-cahaya tampak (UV-Visible atau UV-Vis), circular dishroism (CD), cyclic voltammeter (CV), dan spektrometer massa / mass spectrometer (MS).
Spektrofotometer UV-Vis
Instrumen pertama yang sering digunakan adalah spektrofotometer UV-Vis. Instrumen ini dapat menganalisis senyawa berwarna yang berasal dari ion logam transisi. Senyawa lain yang dapat dianalisis yaitu senyawa dengan gugus kromofor. Gugus kromofor ditandai dengan ikatan rangkap atau ikatan tak jenuh. Fungsi utama instrumen ini adalah validasi pengenceran. Untuk memudahkan para pembaca, penulis akan memberikan analogi yang berhubungan dengan Hukum Lambert-Beer.
Menurut Hukum Lambert-Beer, absorpsi (absorbance) A optimum untuk mengukur suatu larutan berkisar antara A = 0,3–0,8. Informasi yang dibutuhkan adalah intensitas sinar yang terserap oleh senyawa. Intensitas sinar tersebut didapatkan melalui perhitungan intensitas sinar datang dikurangi dengan intensitas sisa yang ditangkap oleh detektor. Jika larutan terlalu encer (A < 0,3), sinar datang dari sumber energi dikhawatirkan tidak berinteraksi dengan senyawa yang terdispersi dalam larutan, sehingga intensitas sinar yang terekam oleh detektor tidak merepresentasikan intensitas yang sesungguhnya. Sebaliknya, jika larutan terlalu pekat (A > 0,8), senyawa dalam larutan akan saling berinteraksi dan melepaskan sejumlah energi sehingga sinar datang akan berinteraksi dengan senyawa yang telah mengalami perubahan pada energinya. Di sini, intensitas sisa juga tidak dapat digunakan untuk merepresentasikan nilai yang sesungguhnya.
Dalam kasus yang lain, seorang peneliti ingin mengamati puncak serapan suatu senyawa pada panjang gelombang (λ) antara 700-300 nm. Saat pengukuran pada λ antara 700-500 nm, absorbance naik dari 0,3 menuju 0,9 lalu peneliti menghentikan pengukurannya. Kemudian, peneliti mengencerkan larutan induk menjadi sepersepuluh kali konsentrasinya. Setelah dilakukan pengukuran, absorbance mengalami kenaikan dari 0,4 menuju 0,8 pada λ antara 500-300 nm. Berdasarkan informasi pengukuran tersebut, peneliti mendapatkan dua buah spektra, yaitu spektra larutan induk dan larutan induk yang diencerkan sepersepuluh kali. Setelah dihitung dan diplot pada suatu perangkat lunak, kurva λ vs log absortivitas molar (log ε) dapat diperoleh. Pengenceran tersebut dapat dikatakan akurat apabila kedua kurva saling tumpang antara satu dengan yang lain. Contoh kurva λ vs log ε dari salah satu publikasi Konno dkk. (1994) diberikan pada gambar.
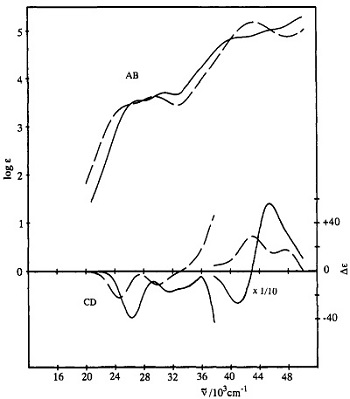
Selain itu, spektrofotometer UV-Vis dapat memberikan informasi mengenai jenis serapan suatu ion logam atau gugus fungsi tertentu pada senyawa-senyawa koordinasi. Fenomena tersebut ditandai dengan puncak-puncak yang muncul pada kurva λ vs. ε. Secara umum, senyawa-senyawa koordinasi memiliki satu atau lebih dari 4 jenis serapan. Serapan-serapan tersebut muncul karena elektron bertransisi atau berpindah dari suatu tingkat energi ke tingkat energi yang lain. Keempat macam serapan tersebut adalah serapan transisi d–d (terjadi pada sub kulit d pada ion logam), serapan transisi elektron dari ligan menuju logam (ligand to metal charge transfer, LMCT), transisi elektron dari logam menuju ligan (metal to ligand charge transfer, MLCT), dan transisi elektron dari π-bonding ligan menuju π-anti bonding ligan (ligand to ligand charge transfer).
Khusus LMCT dan MLCT, transisi elektron menyebabkan perubahan bilangan oksidasi ion pusat dan beranalogi dengan reaksi reduksi dan oksidasi. Penjelasan lebih lanjut mengenai keempat jenis transisi ini akan dipaparkan pada artikel yang lain. Pada gambar berikut ditunjukkan salah satu contoh kurva λ vs. ε untuk senyawa koordinasi berbasis ion nikel yang dikutip dari publikasi Sameshita dkk. (2009).
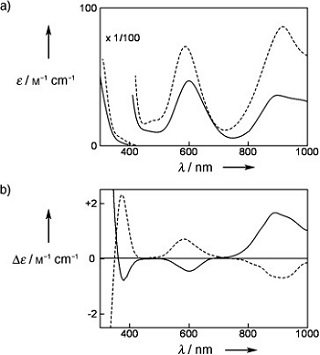
Pada gambar bagian (a) di atas, dua puncak serapan muncul pada panjang gelombang 901 dan 600 nm yang keduanya menunjukkan keberadaan ion nikel dengan geometri oktahedral. Panjang gelombang 901 mn berasal dari transisi elektron 3T2g → 3A2g dan 600 nm berasal dari transisi elektron 3T1g → 3A2g. Notasi-notasi transisi elektron tersebut terkait dengan teori simetri dan grup titik yang tidak dibahas dalam artikel ini.
Circular Dishroism (CD)
Analisis senyawa koordinasi menggunakan CD berfungsi sebagai pelengkap analisis UV-Vis, seperti pada dua gambar di awal. Penggunaan instrumen CD digunakan untuk mendeteksi fenomena optik aktif. Berdasarkan gambar kedua, senyawa koordinasi (Λ)2-[Au3{Ni(L-cys)3}2]5- dan (Δ)2-[Au3{Ni(L-pen)3}2]5- memiliki pola kurva CD yang berbeda walaupun kedua reaktan memiliki arah orientasi optik aktif yang sama (L). Skema reaksi kimia pada publikasi Sameshita dkk. (2009) ditunjukkan pada gambar di bawah ini.
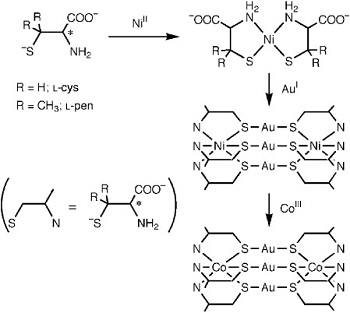
Berdasarkan penjelasan dalam publikasi tersebut, perbedaan pola pada kedua spektra CD disebabkan oleh gugus R (ligan sistein, R = ─H dan ligan penisilamin, R = ─CH3). Ketidaksamaan rantai cabang kedua ligan ini menyebabkan perubahan pola spektra secara total. Fenomena-fenomena unik seperti ini adalah satu dari beberapa topik unggulan bagi para peneliti senyawa koordinasi untuk mempublikasikan risetnya di jurnal-jurnal dengan impact factor yang tinggi.
Cyclic Voltammetry (CV)
Instrumen penunjang analisis fase larutan yang lain adalah CV. Instrumen CV sangat penting dalam memberikan informasi berupa bilangan oksidasi ion pusat pada senyawa koordinasi. Singkatnya, prinsip dasar CV adalah mengoksidasi dan mereduksi senyawa atau sampel. Sampel yang berhasil dioksidasi atau direduksi akan menghasilkan puncak pada voltammogram hasil pengukurannya.
Bagian penting yang perlu dicermati sejak awal adalah bagian voltammogram yang mengalami reaksi oksidasi dan reduksi akan terpisah di sebelah kanan dan kiri dari titik awal (initial scanning point) atau bisa berlaku sebaliknya. Posisi berada di bagian kanan atau kiri sangat bergantung pada perusahaan manufaktur instrumen tersebut. Jumlah puncak yang muncul berbanding lurus dengan banyaknya perubahan bilangan oksidasi ion pusat.
Di sisi lain, perubahan bilangan oksidasi ion pusat pada senyawa koordinasi juga mengubah konstruksi strukturnya. Kadang kala fenomena perubahan struktur dalam fase larutan disertai dengan perubahan warna. Gambar berikut adalah salah satu contoh penelitian yang sangat langka, yaitu investigasi dan isolasi senyawa koordinasi dengan ion pusat NiII/III/IV.
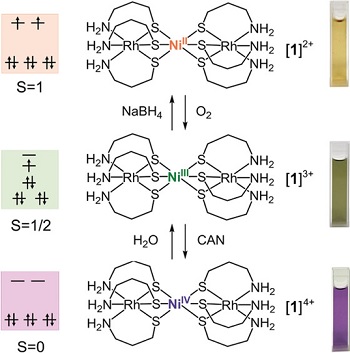
Reaksi isolasi seperti gambar di atas dimulai dari isolasi senyawa koordinasi dengan ion pusat NiIII. Kemudian peneliti mencoba untuk mengoksidasi senyawa tersebut dengan oksidator kuat (ceric ammonium nitrate, CAN). Warna larutan berubah dari hijau tua menjadi ungu. Selanjutnya, peneliti mencoba mereduksi senyawa tersebut dengan reduktor (NaBH4). Sesuai dugaan, warna larutan juga berubah dari hijau tua menjadi kuning. Hal tersebut mengindikasikan bahwa bilangan oksidasi nikel mengalami perubahan saat dioksidasi maupun direduksi. Voltammogram dari ketiga senyawa tersebut disajikan pada gambar di bawah.
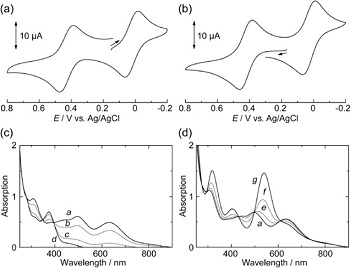
Berdasarkan bagian (a) di atas, sumbu-x akan bernilai negatif jika bergeser ke arah kanan dan begitu pula sebaliknya. Hal itu menunjukkan bahwa senyawa koordinasi akan teroksidasi saat titik scan menuju ke bagian kanan dari titik awal (perhatikan tanda dan arah panah). Kemudian, senyawa akan tereduksi saat titik scan bergerak ke bagian kiri.
Pada Gambar (a), senyawa koordinasi dengan ion pusat NiIII mengalami oksidasi yang ditunjukkan dengan munculnya puncak disekitar E = 0.10 V (kisaran). Puncak tersebut menandakan bahwa ion pusat NiIII telah teroksidasi menjadi NiIV. Setelah keadaan optimum tercapai, ion pusat NiIV akan kembali menuju bilangan oksidasi mula-mula, NiIII, ditunjukkan dengan puncak terbalik yang berada tepat di bawah dari puncak sebelumnya. Setelah itu, ion pusat NiIII akan tereduksi menjadi NiII yang ditunjukkan dengan kemunculan puncak di sekitar E = 0.45 V (kisaran). Kemudian, NiII akan kembali lagi menjadi NiIII dengan puncak berlawanan yang berada tepat di atas puncak sebelumnya dengan E = 0.40 V (kisaran).
Keunikan dari publikasi ini adalah fenomena distorsi Jahn-Teller yang terjadi. Distorsi Jahn-Teller sering muncul pada senyawa-senyawa koordinasi dengan ion pusat CuII (d9). Akan tetapi, publikasi ini menyajikan fenomena serupa dengan NiIII (d7) sebagai ion pusatnya. Saat ini, hanya beberapa publikasi yang membahas secara mendetail tentang distorsi Jahn-Teller pada ion pusat NiIII serta isolasi ion pusat NiII/III/IV. Panjang ikatan dari senyawa-senyawa koordinasi dengan ion pusat NiII/III/IV ditunjukkan pada gambar berikut ini.

Mass Spectroscopy (MS)
Instrumen terakhir dalam artikel ini adalah MS. Analisis menggunakan MS bertujuan untuk membuktikan keberadaan fragmen senyawa koordinasi yang dalam berbentuk ion positif, ion negatif, dan molekul netral. Sampel yang dimasukkan ke dalam tabung pengion (ionizer tube) akan mengalami pemecahan menjadi fragmen-fragmennya. Jumlah fragmen yang teredeteksi akan sangat banyak namun bagian terpenting adalah fragmen dengan kelimpahan tertinggi. Jika dilakukan pembesaran pada sprektra suatu fragmen maka pola pemecahan akan terlihat jelas. Pola pemecahan inilah yang digunakan sebagai standar atas asumsi fragmen senyawa yang peneliti duga sebelumnya. Dengan demikian, hasil analisis spektra MS adalah kecocokkan antara fragmen standar (simulation atau disingkat simu.) dengan fragmen dugaan dari peneliti (observed atau disingkat obs.). Spektra keduanya dinyatakan valid apabila perbedaan antara keduanya hanya berkisar m/z = 0.1. Berikut adalah salah satu contoh spektra MS.
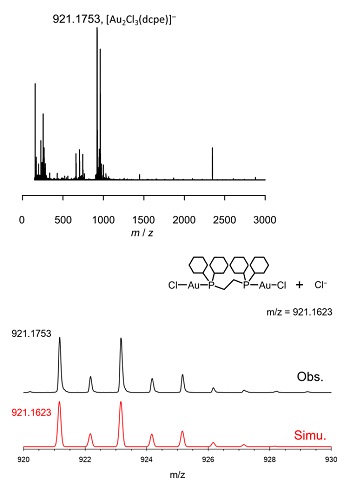
Kekurangan analisis ini terletak pada reaksi kesetimbangan saat kristal dilarutkan pada pelarut tertentu. Reaksi kesetimbangan akan memicu terjadinya transformasi struktur yang berbeda dari struktur sebelumnya. Namun fenomena tersebut tidak selalu terjadi pada semua senyawa koordinasi.
Berdasarkan pemaparan beberapa instrumen di atas, karakterisasi dan analisis senyawa koordinasi sangat penting untuk melengkapi data-data yang diperoleh dari karakterisasi dan analisis senyawa pada fase padat atau kristalnya. Pengenalan lebih jauh mengenai teori dasar kimia koordinasi juga penting untuk dipahami guna memperoleh informasi yang maksimal dari hasil analisis instrumen yang digunakan.
Bahan bacaan:
- Konno, T., Okamoto, K., and Hidaka, J., 1994, Synthesis and Properties of T-Cage-Type S-Bridged RhIIIZnII Octanuclear Complexes with 2-Aminoethanethiolate or L-Cysteinate, Chem., 33, 538-544.
- Sameshima, Y., Yoshinari, N., Tsuge, K., Igashira-Kamiyama, A., and Konno, T., 2009, A Multinuclear Coordination System of L-Cysteine and L-Penicillamine That Induce Opposite Chiralities at Metal Center, Chem. Int. Ed., 48, 8469-8472.
- Kouno, M., Yoshinari, N., Kuwamura, N., Yamagami, K., Sekiyama, A., Okumura, M., and Konno, T., 2017, Valence Interconversion of Octahedral Nickel (II/III/IV) Centers, Chem. Int. Ed., 56, 13762-13766.
Penulis:
Benny Wahyudianto, Mahasiswa Master di Osaka University, Jepang.
Kontak: benny(dot)wahyudianto(dot)a(at)gmail(dot)com.



