Pepatah mengatakan “malu bertanya, sesat di jalan”. Biar tidak tersesat di jalan, yuk kita bantu Mr. Chem menemukan alamat elektron. Mr. Chem ditugasi untuk mencari keberadaan suatu elektron dari sebuah atom. Entah “kesalahan” apa yang elektron ini lakukan, sehingga kamu pun harus ikut membantunya untuk menemukan “alamat” elektron tersebut. Cara membantu Mr. Chem ya tentu saja dengan banyak bertanya kepada masyarakat dunia yang mengetahui jejak keberadaan elektron. Kamu bisa membantu Mr. Chem untuk mencari tahu ciri-ciri atau sifat elektron dengan bertanya kepada beberapa saksi mata di mana elektron tersebut berada.
Menurut cerita di kalangan ilmuwan, elektron biasanya tinggal di sebuah atom yang ukurannya sangat kecil karena atom merupakan bagian terkecil dari suatu materi yang masih memiliki subpartikel atom. Ternyata katanya setiap atom yang berbeda jenisnya memiliki jumlah elektron yang berbeda pula. Kemudian elektron ternyata tinggal tidak jauh dari pusat atom, yang disebut inti atom, yang di dalamnya terdapat proton dan neutron yang tersusun rapi.
Atom berukuran sangat kecil sehingga hanya orang-orang tertentu yang bisa mengidentifikasi tempat kemungkinan elektron tersebut berada. Mengingat pentingnya “alamat” elektron ini, Mr. Chem sudah banyak menghabiskan biaya, waktu, dan tenaganya untuk mencari elektron tersebut. Entah harus mencari ke mana lagi “alamat” elektron ini. Menurut Mr. Chem, jika kamu menemukan “alamat” elektron tersebut berarti kamu menemukan masa depan manusia yang lebih baik.
Akhirnya secercah harapan pun muncul. Pada tahun 1897 berangkatlah Mr. Chem ke negara Inggris menemui paman Thomson di Trinity College. Menurut Thomson, elektron itu bermuatan negatif karena partikel ini dapat tertarik oleh kutub positif pada sinar katode. Namun, Mr. Chem tidak langsung puas begitu saja dengan keterangan paman Thomson. Pada tahun 1913 Mr. Chem pergi ke negara Denmark menemui seseorang yang bernama Mas Niels Bohr di Universitas Copenhagen. Mas Bohr menyatakan bahwa elektron beredar mengelilingi inti atom pada lintasan tertentu dan dapat berpindah dari satu lintasan ke lintasan yang lain ketika menyerap atau melepas energi.
Beberapa tahun kemudian, sekitar tahun 1925 muncul berita dari negara Prancis bahwa elektron dapat bersifat partikel dan gelombang. Hal tersebut diungkapkan oleh Bang Louis de Broglie dari Universitas Paris. Pada tahun yang sama, di Universitas Leipzig Jerman, ternyata Om Heisenberg memberikan pernyataan lain yaitu elektron sulit ditemukan secara pasti, namun tempat nongkrong-nya (baca: kebolehjadian) bisa ditemukan.
Petualangan Mr. Chem tersebut akhirnya membuahkan hasil yang cemerlang. Ia mampu menuliskan riwayat dari kisah perjalanan pencarian elektron dalam sebuah cerita menarik yang dikisahkan sebagai berikut.
Elektron tinggal di sebuah rumah mungil bersama dua saudara angkatnya. Para tetangga memanggil rumah mungil itu dengan sebutan atom. Elektron adalah anak tertua. Kelahirannya dibantu oleh Om J. J. Thomson pada tahun 1897. Semenjak dalam kandungan dia sering dipanggil dengan nama Sinar Katode karena Elektron merupakan anak yang diperoleh melalui tabung sinar katode dan perkembangannya selalu dipantau oleh Om William Crookes. Setelah lahir, ia diberi nama Elektron seperti yang diinginkan om G.J Stoney. Beratnya ditimbang oleh Om Robert Milikan ternyata hanya 9,11 x 10-28 gram.
Adiknya yang pertama bernama Proton. Kelahirannya dibantu oleh Om E. Rutherford pada tahun 1906. Dia lebih gendut dibandingkan Elektron karena massanya 1837 kali dari massa Elektron yaitu 1,673 x 10-24 gram. Pada tahun 1932, Elektron mempunyai adik kedua yang diberi nama Neutron. Om James Chadwick yang membantu kelahirannya. Dia hampir sama gendutnya dengan Proton karena massanya adalah 1,675 x 10-24 gram.
Walaupun mereka bersaudara dan tinggal bersama dalam rumah atom tetapi karakter ketiganya berbeda. Elektron paling tidak suka berada di dalam rumah. Baginya dunia terasa sempit jika hanya memandang tembok-tembok yang memisahkannya dengan dunia luar. Berkeliling di halaman rumah lebih mengasyikkan, Elektron dapat berjalan-jalan di taman, memandang bunga-bunga yang berkembang dan menghirup keharumannya.
Saat pagi tiba, mentari akan menyusupkan kehangatannya sehingga Elektron semakin bersemangat untuk terus beraktivitas. Biasanya, Elektron akan bersepeda melalui lintasan yang disebutnya sebagai orbit. Jika dia merasa lelah, Elektron beristirahat dalam orbital. Keaktifan Elektron dianggap perilaku yang negatif oleh keluarganya.
Lain lagi dengan kedua adiknya, mereka lebih suka di dalam kamar. Kamar itu mereka sebut dengan “Nucleus” sehingga mereka berdua dinamakan Nukleon. Walaupun begitu, Elektron tahu jika Proton terkadang tertarik dengan aktvitasnya sehingga mereka sering mencoba bertemu untuk saling curhat sebagai kakak dan adik. Sedangkan Neutron dia sangat cuek. Apapun yang terjadi di dalam rumah atom, dia netral-netral saja.
Bagi keluarga atom, sifat pendiam Proton merupakan sifat yang dianggap positif. Namun bagi Elektron, Proton mempunyai karisma yang membuatnya terlihat sempurna dibandingkan Neutron. Adanya perbedaan karakter antara Elektron dan Proton membuat mereka saling tertarik. Ketertarikan inilah yang membuat beban bagi keduanya karena semestinya itu tidak ada.
Setelah menulis kisah tersebut, Mr. Chem berpesan, “Siapa pun yang dapat menemukan keberadaan posisi elektron pada suatu atom, maka dia dapat mengubah dunia”. Setelah kabar tersebut beredar, Erwin Schrödinger termotivasi untuk mengidentifikasi sifat elektron tersebut. Schrödinger akan membantumu untuk menemukan alamat elektron dengan bantuan persamaan gelombangnya yang hebat untuk menentukan posisi elektron. Hasil dari persamaan gelombang tersebut memunculkan sederetan angka yang disebut bilangan kuantum. Dengan empat bilangan kuantum, nanti kamu dapat dengan mudah menemukan alamat elektron di dalam atom.
Menurut Schrödinger, bilangan kuantum adalah bilangan yang menggambarkan kedudukan atau posisi elektron dalam suatu atom. Untuk itu, Schrödinger memberikan tiga kata kunci bilangan kuantum, yaitu bilangan kuantum utama, azimut, dan magnetik. Kemudian, Otto Stern dan W. Gerlach memberikan satu lagi kata kunci bilangan kuantum, yaitu bilangan kuantum spin. Untuk menemukan elektron, kamu harus melengkapi dan mengungkap makna tiga bilangan kuantum menurut Schrödinger dan satu bilangan kuantum menurut Stern-Gerlach.
Bilangan Kuantum Utama (n)
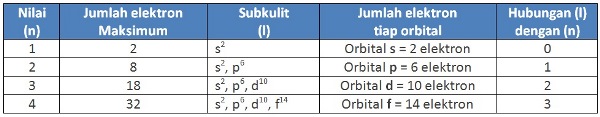
Bilangan Kuantum Utama (n) atau kulit atom adalah bilangan penentu utama tingkat energi elektron dalam atom dan sebagai ukuran kebolehjadian (orbital) ditemukannya elektron pada tingkat energi tertentu. Untuk mengetahui bilangan kuantum utama (n), lihatlah Tabel 1 berikut ini.

Bilangan Kuantum Azimut (l)
Bilangan Kuantum Azimut (l) adalah bilangan yang menunjukkan berapa jumlah subkulit terdapat dalam tiap kulit dan menentukan jenis orbital. Bilangan kuantum azimut (l), dapat diketahui berdasarkan dari bilangan kuantum utama menurut rumus (n-1). Perhatikan Tabel 2.
Bilangan Kuantum Magnetik (m)
Bilangan Kuantum Magnetik (m) adalah bilangan yang menggambarkan kebolehjadian ditemukannya elektron pada orientasi tertentu dalam suatu ruang (tiga dimensi). Perhatikan Tabel 3.

Bilangan Kuantum Spin (s)
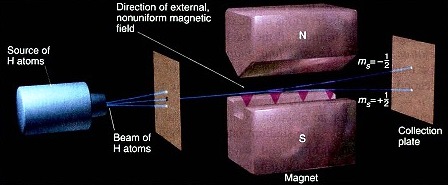
Bilangan Kuantum Spin (s) adalah bilangan yang menunjukkan putaran dan peluang elektron pada setiap orbital. Tanda (+) menunjukkan putaran searah jarum jam, tanda (-) arah sebaliknya sedangkan ½ menyatakan peluang elektron untuk berputar pada porosnya untuk setiap orbital. Jadi, Bilangan Kuantum Spin memiliki nilai +½ dan -½.
Bahan bacaan:
- Kumacheva, Eugenia. 2010. Nelson Chemistry 12, hal. 178-179. Singapura: Prentice Hall.
- http://www.chem-is-try.org/artikel_kimia/tips_dan_opini/cinta-terlarang-elektron
Penulis:
- Maretha Aldha Putri, Siswi SMA Kelas XI IPA, Sekolah Indonesia Kota Kinabalu (SIKK), Sabah-Malaysia.
- Nayudin Hanif, Guru Kimia SIKK, Sabah-Malaysia. Kontak: kimia.mudah07(at)gmail.com.



