Chemistry is everywhere!
Banyak fenomena dalam kehidupan sehari-hari yang tidak bisa lepas dari kimia. Mulai dari yang serius seperti mendesain obat sampai yang terlihat sepele, yaitu diareketika mengonsumsi susu segar atau pasteurisasi. Fenomena diare yang dialami sebagian orang ketika mengonsumsi susu sebenarnya tidak bisa juga dianggap sepele. Faktanya, 60% orang dewasa di dunia ini memang mengalami masalah tersebut. Akibat dari masalah ini ternyata lebih serius,seperti turunnya asupan nutrisi masyarakat.
Tidak perlu diperdebatkan bahwa susu punya nilai nutrisi tinggi. Keterbatasan seseorang mengonsumsi susu karena masalah tersebut berakibat pada tertutupnya peluang mendapatkan asupan nutrisi yang tinggi dari segelas susu. Namun, terlepas dari serius atau tidaknya permasalahan diare akibat mengonsumsi susu, satu hal yang juga tidak banyak kita sadari bahwa ada beberapa aspek kimia dibalik masalah ini.
Lactose intolerance
Dalam bahasa ilmiah, fenomena penyakit diare seseorang setelah minum susu dikenal dengan lactose intolerance (LI). Untuk memahami LI, kita harus mengenal dulu sebuah molekul gula (karbohidrat) disakarida yang ada di dalam susu yang bernama laktosa. Laktosa, sebagaimana halnya disakarida yang lain, tersusun dari dua unit gula sederhana (monosakarida) yaitu glukosa dan galaktosa. Glukosa dan galaktosa tergabung menjadi laktosa lewat sebuah ikatan kovalen yang disebut dengan ikatan glikosidik (glycosidic bond).
Ikatan glikosidik terbentuk antara gugus hemiketal dari salah satu monosakarida dengan gugus hidroksil (OH) dari monosakarida yang lain. Pada laktosa, ikatan ini menghubungkan antara atom karbon nomor 1 (C1) pada gula galaktosa dengan karbon nomor 4 (C4) pada glukosa sehingga disebut dengan β-1,4glycosidic bond. Disebut tipe β, karena posisi OH pada ikatan tersebut berada di atas geometri planar dari molekul gula.
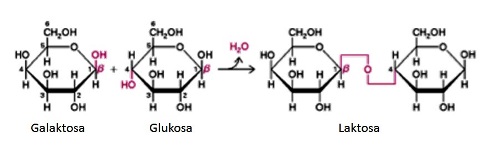
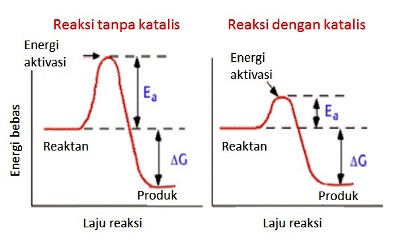
Laktosa tidak bisa dicerna begitu saja dalam saluran pencernaan kita karenaukurannya terlalu besar untuk diserap oleh saluran pencernaan. Laktosa harus dipecah-pecah menjadi gula-gula sederhana (monosakarida), yakni galaktosa dan glukosa. Artinya, kita harus memutus ikatan kovalen β-1,4 glycosidic bond itu supaya laktosa bisa diserap oleh saluran pencernaan kita. Celakanya, bukan perkara gampang memotong ikatan kovalen tersebut karenadibutuhkan energi aktivasi yang sangat tinggi. Untungnya, ada molekul dari golongan protein yang bisa menurunkan energi aktivasi ini sehingga pemotongan ikatan kovalen pada laktosa menjadi lebih mudah dan cepat (terkatalisis). Molekul yang memiliki kemampuan ini disebut dengan enzim (pemercepat/pengkatalis sebuah reaksi kimia). Karena enzim ini bekerja secara spesifik untuk memecah-mecah laktosa, enzim ini disebut dengan laktase (akhiran –se digunakan untuk penamaan enzim).
Laktase secara alami diproduksi oleh manusia sejak bayi. Pada hewan mamalia, produksi laktase ini terhenti setelah fase penyapihan (weaning). Pada manusia, ada keragaman produksi laktasesetelah lepas masa penyapihan. Ada sebagian yang terus memproduksi laktase, atau aktivitas laktase-nya stabil hingga dewasa (disebut dengan kelompok lactase persistence). Tapi, sebagian besar lagi (60-70%) mengalami penurunan produksi atau aktivitas laktase setelah penyapihan, atau bahkan produksinya terhenti sama sekali. Efeknya, dengan penurunan produksi laktase atau (lebih buruknya) laktase tidak diproduksi, laktosa dari susu yang dikonsumsi tidak terpecah menjadi gula sederhana dan memicu gangguan pencernaan dalam bentuk diare.
Jadi, lactose intolerance (LI) ini adalah ketidakmampuan seseorang dalam melakukan proses metabolisme (memecah) laktosa menjadi glukosa dan galaktosa dalam saluran pencernaanya. Ketidakmampuannya merupakan akibat ikatan kovalen yang mengikat glukosa dan galaktosa dalam laktosa tidak terpecah sebagai hasil dari ketiadaan atau penurunan aktivitas enzim tersebut.
Ikatan Kovalen
Kesamaan ikatan kovalen dengan ikatan ionik adalah adanya “pergerakan” elektron diantara atom-atom yang bermuatan. Yang membedakannya adalah, elektron pada ikatan kovalen digunakan secara bersama-sama (shared) antara atom-atom yang berikatan. Atom-atom pada ikatan kovalen tidak memiliki perbedaan elektronegativitas (kekuatan sebuah atom untuk menarik elektron) sehingga tidak ada kencederungan elektron terluar pada masing-masing atom tersebut tertarik ke atom lainnya. Yang terjadi adalah, karena kesamaan elektronegativitas tersebut, elektron terluar pada atom tersebut digunakan bersama pada atom yang berikatan (shared).
Pada ikatan ionik, elektronegativitas atom-atom yang berikatan memilliki perbedaan. Perbedaan ini menyebabkan salah satu atom akan kehilangan elektron terluarnya karena ditarik oleh atom yang lebih elektronegatif. Efeknya, atom yang kehilangan elektron akan bermuatan positif (kation), sedangkan atom yang menarik tambahan elektron bermuatan negatif (anion). Ikatan ionik terjadi antara kation dan anion.
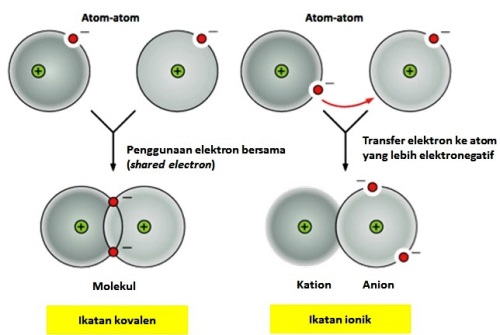
Logika sederhana bisa ditarik untuk mengukur kekuatan ikatan kovalen dibandingkan dengan ikatan ionik. Pada ikatan kovalen, kedua atom menggunakan elektron terluar secara bersama-sama. Dua atom ini “saling membutuhkan” elektron bersama tersebut. Ini menyebabkan kekuatan ikatan kovalen jauh lebih kuat ketimbang ikatan ionik. Dalam ikatan ionik, elektron terluar satu atom seolah-olah “tidak diperlukan” sehingga diberikan begitu saja pada elektron lain yang membutuhkan (yang lebih elektronegatif). “Kebutuhan” elektron pada ikatan ionik tidak dalam konteks “saling membutuhkan”, tetapi lebih pada konteks “satu pihak lebih membutuhkan”. Logika ini bisa saja tidak terlalu tepat, namun cukup untuk menggambarkan bagaimana membandingkan kekuatan ikatan kovalen dan ikatan ionik.
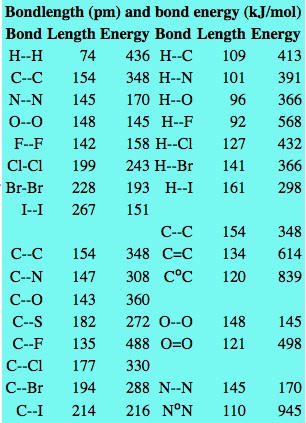
Faktanya memang, energi yang dibutuhkan untuk memecah ikatan kovalen sangatlah besar, rata-rata sekitar 100 kcal/mol. Angka ini 5-10 kali lebih besar dibandingkan dengan energi yang dibutuhkan untuk memecah ikatan ionik, yakni sekitar 10-20 kcal/mol. Tentu saja kekuatan ikatan kovalen ini ditentukan oleh jarak atom. Makin dekat jarak antaratom yang berikatan (ikatan yang terbentuk makin pendek), makin besar kekuatan ikatan tersebut. Jarak antaratom ini dipengaruhi oleh afinitas elektron masing-masing atom, ukuran atom, perbedaan elektronegativitasnya (meskipun atom-atom yang berikatan kovalen secara umum tidak memiliki perbedaan elektronegativitas, tetapi pada faktanya ada perbedaan yang sangat kecil sekitar 0,7. Angka ini bisa diabaikan jika dibandingkan dengan ikatan ionik), dan struktur molekul secara umum.
Pemutusan ikatan kovalen β -1,4 glycosidic bond oleh laktase
Reaksi pemutusan ikatan kovalen antara galaktosa dan glukosa tersebut diawali dengan terjadinya ikatan antara enzim laktase dengan laktosa. Proses ini terjadi dalam “rongga mulut” (binding site/binding pocket) laktase. Perlu diingat bahwa enzim memiliki kecenderungan terhadap substrat tertentu. Artinya, tidak sembarang molekul bisa masuk ke dalam binding pocket.
Kecenderungan ini bisa disebabkan oleh ukuran, gaya elektrostatis dipermukaan binding pocket, dan lain-lain. Mirip dengan kunci dan lubangnya, lubang kunci sangat spesifik, hanya pas untuk anak kunci tertentu. Pola ini disebut “key lock paradigm”, yang berlaku juga untuk menggambarkan kesukaan enzim untuk “menangkap” substrat tertentu. Dengan demikian, “rongga mulut” enzim laktase memang spesifik hanya bisa dimasuki laktase (sebagai substrat).
Di dalam “rongga mulut” laktase inilah “gigi-gigi” yang berfungsi memotong β-1,4 glycosidic bond berada. “Gigi-gigi” (disebut dengan sisi aktif) tersusun dari molekul asam amino. Perlu dicatat bahwa enzim adalah kelompok biomakromolekul protein yang merupakan polimer dari asam amino. Ada 20 asam amino penyusun protein yang memiliki gugus fungsional berbeda-beda sehingga bisa bersifat polar atau nonpolar.
Asam amino yang berfungsi sebagai sisi aktif pada enzim laktase adalah asam glutamat (Glu). Setidaknya ada dua Glu yang sangat berperan, sebut saja Glu-A dan Glu-B, sehingga total ada 3 asam amino yang berperan sebagai sisi aktif pada enzim laktase. Glu bersifat asam dan (tentu saja) cenderung polar karena memiliki gugus fungsi asam karboksilat (-COOH). Nilai pKadari gugus asam karboksilat adalah sekitar 4,1, artinya jika pH fisiologis dalam binding pocket laktase adalah 7,4, maka asam glutamat akan bermuatan negatif. Bagaimana “gigi-gigi” ini bekerja dalam proses pemotongan ikatan kovalen antara galaktosa dan glukosa? Proses kerja ketiga asam amino tersebut setidaknya bisa dibagi dalam beberapa tahap.
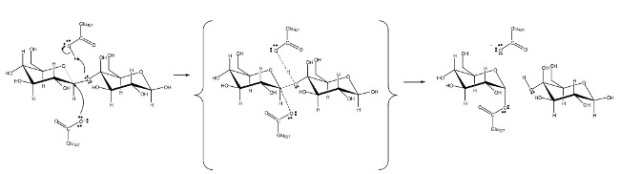
Tahap pertama, Glu537 akan berperan sebagai nukleofil karena bermuatan gugus karboksilat akan bermuatan negatif. Sifat nukleofilik ini akan mendorong elektron bergerak ke karbon anomer (karbon nomor 1) dari molekul galaktosa yang bersifat elektrofil. Bagaimana bisa karbon anomer ini bersifat elektrofil sementara? Disini peranan Glu461 yang posisinya berdekatan atom oksigen yang berada ditengah galaktosa dan glukosa (disebut dengan oksigen glikosidik). Gugus asam karboksilat pada Glu461, dengan sifat asamnya, memprotonasi oksigen glikosidik.Hal ini menyebabkan ikatan kovalen karbon anomer galaktosa dengan oksigen glikosidik menjadi terganggu dan terputus. Pada tahap ini β-1,4glycosidic bond sebenarnya sudah terputus.
Hasil akhirnya adalah bagian molekul galaktosa (disebut dengan galaktosil) distabilkan oleh Glu537 lewat nukleofiliknya. Sementara itu, bagian molekul glukosa distabilkan oleh Glu461 lewat protonasi okisgen glikosidik. Inilah fase transisi (transition state) reaksi tersebut sebelum produk akhirnya (galaktosa dan glukosa) benar-benar dihasilkan dari proses pemotongan β-1,4glikosidik-nya. Fase transisi bersifat sangat labil. Glu537 dan Glu461 punya peran vital menjaga stabilitas fase transisi ini.
Tahap kedua adalah transisi fase transisi ke produk akhir. Bagian glukosa bisa dengan mudah lepas dari Glu461 dengan protonasi oksigen glikosidik, menyebabkan terbentuknya gugus hidroksil (OH) sebagai produk protonasi tersebut. Efek dari protonasi oksigen glikosidik oleh Glu461, menyebabkan asam amino ini bersifat negatif. Sifat ini penting untuk bisa membantu Glu357 melepas galaktosil secara sempurna dan stabil. Pada fase ini, galaktosil yang distabilisasi lewat nukleofilik Glu537 harus ditransfer ke molekul lain (molekul akseptor) supaya terlepas dari enzim laktase. Molekul air (H2O) akan berperan sebagai akseptor dalam proses transfer ini.
Selama proses transfer, karbon anomer distabilisasi oleh Glu537 dan atom oksigen dari cincin galaktosil. Glu461, karena bermuatan negatif, bisa membantu pelepasan ini dengan cara mengambil proton dari molekul akseptor. Hasilnya, molekul akseptor bersifat nukelofilik yang bisa menggantikan posisi Glu537 untuk menstabilisasi karbon anomer dari galaktosil. Masuknya molekul akseptor (H2O) menggantikan Glu357 menyebabkan terbentuknya gugus hidroksil yang berarti mengubah galaktosil menjadi galaktosa.
Proses sederhana membuktikan bahwa reaksi pemecahan laktosa menjadi glukosa dan galaktosa melibatkan (penambahan) molekul air, atau hidrolisis. Akan tetapi, jika kita “hanya mengandalkan” molekul air saja, proses ini akan berjalan sangat lama. Pada pH fisiologis, molekul air tidak bisa secara kuat memprotonasi oksigen glikosidik, sebagaimana Glu461. Disisi lain, molekul air juga tidak bisa begitu mudah menjadi nukelofil untuk bisa menyerang karbon anomer dari galaktosa, sebagaimana Glu357. Disinilah peranan laktase sebagai katalisator reaksi. Laktase membangun lingkungan yang memudahkan air masuk ke dalam reaktan dengan memprotonasi oksigen glikosidik dan menjadikan molekul air sebagai nukleofil.
Solusi bagi penderita LI
Dari uraian diatas, kita bisa tahu bahwa titik masalah penderita LI adalah ketiadaan enzim laktase yang menyebabkan ketidakmampuan si penderita untuk memecah ikatan kovalen β-1,4 glycosidic bond pada laktosa susu. Dengan melihat permasalahan ini kita bisa membangun solusi sederhana bagi penderita LI, yakni memberi mereka enzim laktase. Tentu saja secara praktik bukan berarti si penderita meminum atau disuntik dengan enzim laktase. Cara paling sederhana adalah menambahkan laktase pada susu sebelum diminum oleh penderita LI. Ini bisa dilakukan dengan proses fermentasi (pemeraman) dengan memanfaatkan berbagai jenis mikroorganisme, baik dari kelompok bakteri maupun yeast.
Berbagai kelompok mikroorganisme menghasilkan enzim laktase dari selnya. Artinya, ketika kita memfermentasi susu dengan mikroorganisme, enzim laktase dari mikroorganisme tersebut akan memecah laktosa pada susu tersebut. Hasil akhirnya, susu fermentasi tidak lagi mengandung laktosa, tetapi sudah terpecah-pecah menjadi galaktosa dan glukosa oleh enzim laktase mikroorganisme. Tidak heran kalau kita sering melihat penderita LI tidak mengalami masalah diare jika minum yoghurt, kefir, dan jenis produk susu fermentasi lainnya. Hal ini karena pada produk susu fermentasi tersebut laktosa sudah terpecah selama proses fermentasi.
Jika tidak ingin memilih pendekatan lewat fermentasi, bisa juga dilakukan inovasi lain. Misalnya dengan menambahkan laktase secara langsung yang tentunya bisa berdampak pada aspek ekonomi dan efisiensi. Inovasi lain bisa saja dengan mensintesis senyawa lain (kimia sintetis) yang bisa menggantikan fungsi laktase tapi lebih efisien dan ekonomis. Apakah hasilnya akan lebih baik dari proses fermentasi? Tentu saja itu harus diteliti lebih jauh, termasuk juga (mungkin) riset panjang untuk bisa mensintesis senyawa lain yang lebih sederhana dari laktase tetapi lebih efisien dan ekonomis. Apapun itu, setidaknya kita sekarang paham, bahwa fenomena diareketika minum susu adalah bagian dari fenomena kimia dalam kehidupan kita sehari-hari. Memahami kimia tidak lain upaya untuk memahami banyak hal terjadi disekitar.
Benar, kan? Chemistry is everywhere!
Bahan bacaan:
- http://www.1cro.com
- http://people.seas.harvard.edu
- http://www.science.uwaterloo.ca
- http://www.sas.upenn.edu
Penulis:
- Cahyo Budiman, peneliti biokimia protein di Okinawa Institute of Science and Technology (OIST), Jepang, serta dosen Fakultas Peternakan, Institut Pertanian Bogor (IPB), Indonesia. Kontak: cahyo82(at)gmail(dot)com.
- Yuyu Yuliana, pengajar kimia di SMAN 1 Babakan, Cirebon. Kontak: uuyuliana(at)yahoo(dot)co(dot)id.



