Praktikum kimia dengan tema sintesis senyawa kompleks banyak dijumpai di hampir seluruh Perguruan Tinggi Indonesia. Menurut asumsi pribadi penulis, banyak faktor yang melatarbelakangi alasan untuk memilih tema ini, seperti akses ketersediaan alat bahan, prosedur kerja yang sederhana, dan pembahasan di sisi teori yang mudah dicerna. Kali ini, penulis akan menelaah praktikum kimia yang berjudul sintesis senyawa kompleks cis- dan trans- kalium bisoksalatodiakuokrom(III), K[Cr(H2O)2(C2O4)2] atau K[Cr(H2O)2(ox)2] untuk memperkaya referensi bagi para mahasiswa-mahasiswi dalam rangka menulis laporan akhir praktikum di setiap sesinya.
Ditinjau dari produk yang terbentuk, senyawa kompleks K[Cr(H2O)2(ox)2] tersusun atas dua jenis ligan, yaitu H2O sebagai ligan monodentat dan C2O42- (ion oksalat) sebagai ligan bi atau multidentat. Berdasarkan deret spektrokimia, molekul H2O termasuk salah satu ligan yang lebih kuat dari ion logam oksalat. Oleh karena itu, kompleks yang terbentuk seharusnya hanya menghasilkan satu produk saja dengan ligan H2O secara keseluruhan. Di sisi lain, pendekatan derajat kebebasan Gibbs (ΔG) yang erat kaitannya dengan derajat entropi (ΔS) mengisyaratkan bahwa reaksi dapat berlangsung apabila terjadi peningkatan jumlah spesies dari reaktan menuju ke produk. Dengan kata lain, ΔS berbanding terbalik dengan ΔG. Hal tersebut sesuai dengan formula: ΔG = ΔH – T/ΔS.
Kebanyakan senyawa kompleks dihasilkan dari reaksi kimia antara ion-ion atau logam-logam transisi dan ligan yang dikarenakan ion-ion atau logam-logam transisi tersebut memiliki subkulit orbital d yang kosong, baik di subkulit orbital d dalam atau subkulit orbital d luar, sebagai wadah untuk menerima pasangan elektron bebas (PEB) dari ligan. Selain itu, pengertian dari logam transisi itu sendiri adalah logam yang dapat mengeksitasi elektronnya di orbital d(t2g) menuju orbital d(eg) atau disebut sebagai d-d transition.
Contoh kelompok logam transisi adalah atom skandium (Sc) hingga tembaga (Cu), sedangkan seng (Zn) tidak termasuk di dalamnya. Seng bukan termasuk golongan logam transisi karena orbital d-nya sudah terisi penuh oleh elektron dalam bentuk atom maupun ionnya. Namun, ion Zn2+ masih dapat membentuk senyawa kompleks bergeometri ion pusat oktahedral dengan hibridisasi sp3d2. Di sisi lain, kebanyakan ion logam transisi, khususnya periode 3, memiliki bilangan oksidasi 2+ atau bivalen, tetapi ion kromium memiliki bilangan oksidasi 3+ atau trivalen, yang terjadi secara alamiah. Sifat alamiah ini sangat berhubungan dengan tingkat ion merujuk pada teori medan kristal.
Jika ion Cr2+ dan Cr3+ dibandingkan, ion Cr2+ memiliki kestabilan yang ‘lebih rendah’ dibandingkan dengan ion Cr3+ dengan kondisi berikatan dengan spesies bermedan ligan kuat atau lemah. Ion Cr2+ yang mungkin terbentuk akan memiliki konfigurasi elektron d4 pada subkulit orbital d-nya. Kemudian, posisi elektron terakhir akan berada di orbital d jika ligan bermedan kuat atau berada di orbital d jika ligan bermedan lemah.
Terbentuknya ion Cr3+ secara alamiah berdampak pada besar jari-jari ion yang lebih kecil dan mampat apabila ion tersebut dibandingkan kembali dengan ion Cr2+. Jika ion Cr3+ berinteraksi dengan spesies bermuatan negatif, faktor sterik dari bentuk ligan yang ruah menjadi salah satu faktor penentu terhadap kestabilan dan geometri ion pusat pada senyawa kompleks yang terbentuk.
Faktor sterik ini dihasilkan dari dua penyebab. Pertama, gaya tolak antara elektron yang berada di kulit terluar (elektron valensi) dari ion logam dengan PEB ligan. Perlu dicermati bahwa elektron-elektron yang berada di subkulit orbital d ion pusat tidak berinteraksi secara langsung dengan ligan, tetapi keberadaannya tetap mempengaruhi kestabilan senyawa kompleks yang terbentuk. Kedua, gaya tolak elektron di antara ligan itu sendiri. Semakin pendek jari-jari ion logam akan berdampak pada semakin memendeknya ikatan kovalen koordinasi yang terbentuk dengan ligan.
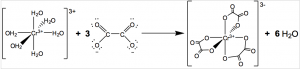
Memendeknya ikatan kovalen koordinasi dan besarnya tolakan antarmuatan negatif tersebut dapat distabilkan dengan memperbesar sudut ikatanya. Penjelasan serupa juga telah disampaikan pada artikel kimia penulis yang berjudul Pendekatan Kimia Koordinasi dari Diagram Orbital Molekul (Majalah 1000guru Edisi ke-95). Kemungkinan inilah yang menyebabkan terbentuknya ion kompleks [Cr(H2O)2(C2O4)2]– saat kombinasi ligan H2O/ion oksalat direaksikan dengan ion Cr3+. Reaksi pembentukkan ion senyawa kompleks [Cr(H2O)2(C2O4)2]– via mekanisme reduksi-oksidasi ditunjukkan sebagai berikut.
Setengah reaksi reduksi, ion Cr6+ menjadi Cr3+:
6e– + 14H+(aq) + Cr2O72-(aq) 2Cr3+(aq) + 7H2O(l)
Setengah reaksi oksidasi, sebagai inisiator pembentukan gas karbondioksida, CO2(g):
C2O42-(aq) 2CO2(g) + 2e–
Sesaat setelah ion Cr3+ terbentuk, sisa ion oksalat dan H2O segera bereaksi dan selanjutnya membentuk ion kompleks [Cr(H2O)2(C2O4)2]–. Keberadaan ion kalium dari reaktan K2Cr2O7 akan menetralkan ion kompleks yang terbentuk menjadi K[Cr(H2O)2(C2O4)2]. Setelah itu, penetesan pelarut etanol pada kristal atau larutan ion kompleks tersebut bertujuan untuk mempercepat proses pengkristalan senyawa kompleks yang memiliki kecenderungan bersifat hidrofilik atau mudah terlarut dalam air. Perbedaan polaritas antara H2O dan etanol inilah yang sangat zalim digunakan untuk mengisolasi dan memurnikan senyawa kompleks yang akan dianalisis.
Senyawa kompleks K[Cr(H2O)2(C2O4)2] dapat dikondisikan dan diisolasi dalam isomer cis- dan trans-nya. Untuk mengisolasi senyawa kompleks trans-K[Cr(H2O)2(C2O4)2], masing-masing reaktan K2Cr2O7 maupun asam oksalat, H2C2O4 dilarutkan terlebih dahulu ke dalam pelarut H2O sebelum keduanya direaksikan. Kemungkinan senyawa kompleks berisomer trans- terbentuk karena ligan-ligan memiliki waktu reaksi yang cukup untuk memosisikan strukturnya pada posisi yang paling stabil terhadap ion Cr3+. Dengan kata lain, posisi trans- pada ligan-ligan terhadap ion Cr3+ akan menghasilkan interaksi yang maksimum dan energi interaksi yang minimum. Berdasarkan fenomena tersebut, senyawa trans-K[Cr(H2O)2(C2O4)2] dikelompokkan sebagai senyawa yang stabil secara termodinamika.
Senyawa dikatakan stabil atau tidak stabil secara termodinamis berdasarkan selisih energi interaksi antara reaktan dan produk. Apabila energi interaksi antaratom dalam senyawa produk lebih rendah dibandingkan reaktan, produk tersebut dapat dikatakan stabil secara termodinamika. Sebaliknya, apabila energi interaksi antar atom dalam senyawa produk lebih tinggi dibandingkan reaktan maka produk tersebut dapat dikatakan tidak stabil secara termodinamika. Di saat yang hampir bersamaan, reaktan tidak langsung membentuk senyawa kompleks akhir, tetapi fenomena penyusunan ulang ligan terjadi hingga akhirnya senyawa kompleks berisomer trans-K[Cr(H2O)2(C2O4)2] terbentuk.
Berdasarkan fenomena tersebut, trans-K[Cr(H2O)2(C2O4)2] dapat dikategorikan sebagai senyawa tidak reaktif (inert) secara kinetika. Penentuan senyawa dikategorikan tidak reaktif dan labil secara kinetika dapat ditinjau dari kecepatan reaksi kimia terhadap perubahan senyawa reaktan menjadi produk. Semakin lambat perubahan molekul reaktan menuju molekul produk maka semakin tidak reaktif (inert) perubahan molekulnya.
Sebaliknya, senyawa kompleks cis-K[Cr(H2O)2(C2O4)2] dapat diisolasi dari reaksi antara kedua reaktan dengan pelarut air yang terbatas (sekitar 1-3 tetes). Hal tersebut bertujuan untuk mengatur kondisi reaksi pembentukan senyawa kompleks agar fenomena penyusunan ulang ligan terhadap ion pusat Cr3+ tidak berlangsung. Fenomena terbentuknya senyawa kompleks cis-K[Cr(H2O)2(C2O4)2] berkebalikan dari isomer trans-nya dan dikelompokkan sebagai senyawa yang tidak stabil secara termodinamika dan labil secara kinetika.
Untuk mengidentifikasi kedua isomer senyawa kompleks tersebut, metode pengujian secara kualitatif dapat dilakukan dengan cara menetesi masing-masing senyawa kompleks dengan larutan amonia. Penentuan senyawa kompleks yang terbentuk berisomer cis- atau trans- dapat diamati dari perubahan warna yang terjadi saat penetesan larutan amonia. Perlakuan ini adalah salah satu langkah untuk mengganti atau mensubstitusi ligan H2O menjadi NH3. Reaksi substitusi ligan ini hanya terjadi pada senyawa kompleks berisomer cis- saja, sedangkan senyawa kompleks berisomer trans- tidak berpengaruh. Fenomena ini dapat dijelaskan dengan tinjauan kestabilan senyawa secara termodinamika yang telah dijelaskan pada paragraf sebelumnya.
Senyawa kompleks trans-K[Cr(H2O)2(C2O4)2] memiliki kestabilan secara termodinamika yang lebih tinggi dibandingkan dengan senyawa kompleks cis-K[Cr(H2O)2(C2O4)2]. Oleh karena itu, senyawa trans- tidak terpengaruh dengan keberadaan ligan NH3 walaupun kekuatan ligan tersebut jauh lebih besar dibandingkan dengan H2O dalam deret spektrokimia-nya. Pertanyaan yang mungkin tersirat adalah, “Apakah ada kemungkinan reaksi substitusi ligan terjadi antara ion oksalat dengan NH3?” Reaksi tersebut sangat mungkin terjadi, tetapi suhu dan tekanan normal memiliki kecenderungan yang tinggi bahwa ligan bidentat sangat sulit digantikan oleh ligan monodentat. Pernyataan tersebut berbanding lurus dengan pemaparan mengenai derajat entropi (ΔS) yang telah disampaikan di paragraf awal.
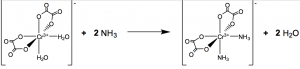
Reaksi substitusi ligan di atas disebabkan oleh gaya tolak yang cukup besar di antara ligan. Gaya tersebut menyebabkan ikatan kovalen koordinasi antara ion pusat dan ligan semakin memanjang dan melemahkan interaksi di antara keduanya. Oleh karena itu, keberadaan ligan NH3 yang lebih kuat dibandingkan dengan H2O mampu menghasilkan produk baru, cis-K[Cr(NH3)2(C2O4)2].
Salah satu fenomena unik yang kerap kali luput untuk dibahas adalah pembentukan senyawa kompleks antara (intermediate species) di antara reaktan dan produk. Reaksi subtitusi ligan dari senyawa kompleks cis-K[Cr(H2O)2(C2O4)2] menuju ke cis-K[Cr(NH3)2(C2O4)2] akan membentuk senyawa antara saat satu ligan NH3 mulai bereaksi dengan cis-K[Cr(H2O)2(C2O4)2]. Senyawa antara yang terbentuk memiliki dua kemungkinan, yaitu senyawa cis-K[Cr(H2O)(C2O4)2] dengan geometri ion pusat piramida alas segiempat (bilangan koordinasi/BK : 5) jika reaksi tersebut mengadopsi mekanisme disosiasi. Kemungkinan kedua adalah pembentukan zat antara cis-K[Cr(NH3)(H2O)2(C2O4)2] (BK : 7) dengan geometri pentagonal bipiramidal jika reaksi tersebut mengadopsi mekanisme asosiasi. Pembentukkan zat antara melalui mekanisme dissosiasif maupun assosiasif berlangsung dengan sangat cepat sehingga pendeteksian keabsahan zat antara tersebut sulit dilakukan.
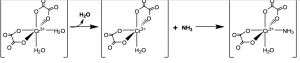

Mekanisme substitusi ligan secara (a) dissosiasi dan (b) assosiasi.
Jika senyawa cis- dan trans- dikarakterisasi, instrumen apakah yang paling tepat untuk mendapatkan hasil analisis yang sesuai? Pertama, UV-Visible spectrophotometer atau absorption spectrophotometer. Penggunaan instrumen ini karena ketiga senyawa yang terbentuk menghasilkan warna kompleks yang berbeda-beda. Senyawa kompleks cis-K[Cr(H2O)2(C2O4)2]; trans-K[Cr(H2O)2(C2O4)2]; dan cis-K[Cr(NH3)2(C2O4)2] secara berurutan berwarna ungu kehitaman, ungu kehitaman, dan hijau tua. Perbedaan warna tersebut akan memunculkan puncak serapan pada panjang gelombang yang berbeda pula sesuai hubungan antara energi dengan panjang gelombang.
Instrumen berikutnya adalah proton-Nuclear Magnetic Resonance (1H-NMR) dan karakterisasi kemagnetan. Senyawa kompleks yang telah kita bahas dalam artikel ini bersifat magnet. Hal tersebut dapat diprediksi dari keberadaan 3 elektron tidak berpasangan pada sub-kulit orbital d ion Cr3+. Besar kemagnetan dari senyawa-senyawa kompleks tersebut seharusnya bernilai saling mendekati. Besar kuantitatif kemagnetan senyawa kompleks dapat dihitung melalui formula magneton Bohr. Sifat kemagnetan dapat diamati juga dengan superconducting quantum interference device (SQUID) atau Vibrating Sample Magnetometer (VSM). Pengukuran NMR pada senyawa bersifat magnet menyebabkan spektra yang terbentuk mengalami pelebaran. Namun, puncak pergeseran kimia (δ) dari lingkungan atom hidrogen yang berada di posisi cis- dan trans- pada masing-masing senyawa kompleks dapat dibedakan. Analisis menggunakan NMR sayangnya masih sangat sulit dilakukan di Indonesia saat ini.
Kesimpulan dari pembedahan praktikum kimia ini adalah senyawa kompleks trans-K[Cr(H2O)2(C2O4)2] lebih stabil dibandingkan dengan senyawa kompleks cis-K[Cr(H2O)2(C2O4)2], sehingga reaksi pergantian ligan NH3 hanya terjadi pada isomer cis-nya .Terakhir dari penulis, pembahasan laporan praktikum ini mungkin tidak seutuhnya dijelaskan secara sempurna. Oleh karena itu, saran yang membangun dari pembaca yang ditinggalkan di kolom komentar akan lebih memperkaya ilmu pengetahuan di bidang kimia dan kaitannya.
Bahan bacaan:
- Efendy, 2007, Teori VSEPR Kepolaran, dan Gaya Antarmolekul, Edisi 3, Bayumedia Publishing, Malang Jawa Timur.
- Efendy, 2011, Perspektif Baru Kimia Koordinasi, Edisi 2, Jilid 1, AIP Publishing, Malang Jawa Timur.
- http://majalah1000guru.net/2016/04/filosofi-kimia-koordinasi/
- http://majalah1000guru.net/2019/02/senyawa-koordinasi/
- http://majalah1000guru.net/2019/04/logam-transisi-klorida/
Ucapan terima kasih:
Penulis mendedikasikan artikel ini untuk Adnan Dhia Alfatih, putra pertama dari Taufik Yoga Utama dan Maya Septavia Setyoningrum (Universitas Gadjah Mada).
Penulis:
Benny Wahyudianto, Mahasiswa Master di Osaka University, Jepang.
Kontak: benny.wahyudianto.a(at)gmail.com



