Fenomena katalisis pada dasarnya adalah kemampuan untuk meningkatkan laju reaksi kimia atau mempercepat tercapainya kesetimbangan kimia dengan penurunan energi aktivasi suatu proses reaksi. Hal ini dicapai dengan menggunakan senyawa yang disebut katalis. Katalis sendiri terlibat dalam reaksi, tetapi tidak dikonsumsi dalam reaksi karena pada akhir reaksi katalis akan diregenerasi kembali.
Katalisis memiliki peran penting untuk menghemat energi produksi, selektivitas produk, pemanfaatan sumber daya yang terbatas, dan tanggung jawab terhadap keberlangsungan lingkungan dalam jangka panjang. Dalam proses industri kimia, konsep katalisis merupakan wujud konversi energi secara modern yang memperhatikan efisiensi produk (dengan meminimalkan produk samping) dan berdasarkan pada konsep teknologi yang memperhatikan keberlangsungan lingkungan. Katalis mengubah kinetika reaksi, tetapi tidak mengubah termodinamikanya.
Nilai katalis baik dalam sektor perbaikan kualitas hidup maupun sektor ekonomi tidak bisa diremehkan. Katalis menunjang hampir semua proses industri kimia. Sekitar 85-90% bahan-bahan kimia yang dibutuhkan sehari-sehari diproduksi dengan proses katalisis. Dari katalis-katalis yang digunakan, katalis heterogen berperan sekitar 80%, katalis homogen berperan sekitar 17%, dan sisanya adalah biokatalis (de Jong, K. P. (1998) Cat Tech, 2, 87).
Pangsa pasar katalis dunia menujukkan peningkatan angka yang semakin besar saat ini pada level lebih dari 20 miliar dolar AS dan diperkirakan bahwa untuk setiap 1 dolar AS yang diinvestasikan untuk katalis dapat menghasilkan keuntungan sampai 1.000 dolar AS. Empat sektor industri yang paling sukses di dunia, yakni industri minyak bumi, produksi bahan kimia, pembangkit energi, dan produksi pangan, bergantung pada katalisis. Total PNB (pendapatan nasional bruto) seluruh dunia untuk sektor ini setidaknya 10 triliun dolar AS.
Pentingnya katalisis dicerminkan pada berbagai sektor dan sesuai perkiraan menunjukkan bahwa katalisis memberikan kontribusi lebih dari 35% dari PDB (pendapatan domestik bruto) dunia. Berdasarkan latar belakang ini, jelas bahwa katalisis merupakan kunci penting teknologi yang mendukung perekonomian.
Ilmuwan pertama pemenang hadiah nobel dalam bidang katalisis adalah Wilhelm Ostwald (1894) yang pada masa itu menjadi Professor Kimia Fisika di Universitas Leipzig, Jerman. Dalam pidatonya saat penganugerahan hadiah Nobel beliau mengatakan:
Katalyse ist die Beschleunigungeines langsam verlaufenden chemischen Vorgangs durch die Gegenwart eines fremden Stoffes. So wurde ich unwiderstehlich zu der Auffassung gedrängt, dass das Wesen der Katalyse nicht in der Hervorbringung einer Reaktion zu suchen ist, sondern in ihrer Beschleunigung …
… Ich würde der Pflicht der Aufrichtigkeit … zuwider handeln, wenn ich unterlassen würde, zu bemerken, dass mir selbst damals dieser Fortschritt keineswegs besonders imponierte …
[Wilhelm Ostwald, Rede zur Nobelpreisverleihung 1909].
Artinya kurang lebih sebagai berikut:
Katalisis adalah percepatan proses kimia yang lambat dengan adanya substansi asing. Jadi, saya tak tertahankan dipaksa sampai pada kesimpulan bahwa esensi katalisis itu tidak dicari pada produksi reaksi, tetapi pada percepatannya.
… saya akan menjalankan tugas kejujuran … yang melanggar, jika saya akan menahan diri, untuk mencatat, lebih-lebih jika menganggap kemajuan saya ini jauh lebih terkesan…
[Wilhelm Ostwald, pidato saat Hadiah Nobel, 1909]
Konsep Ostwald dapat dipahami dengan mudah dari gambar berikut ini.

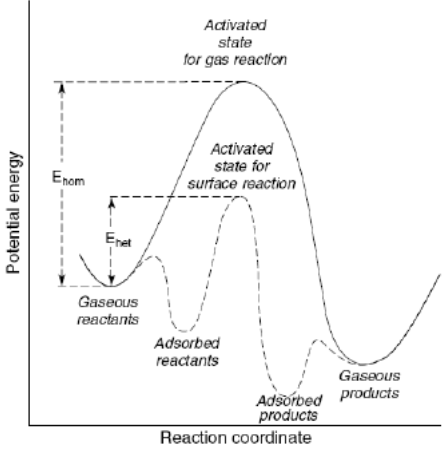
Bayangkan kita ingin menuju rumah rumah kawan yang harus melewati gunung yang sangat tinggi. Tentu banyak energi yang harus kita keluarkan untuk memanjat gunung tersebut. Kita akan mencari jalan lain bagaimana bisa mencapai rumah itu tanpa harus naik gunung, tentunya dengan rute yang berbeda. Begitu juga ilustrasi dalam reaksi. Apabila dalam reaksi antarmolekul gas secara langsung dibutuhkan energi pengaktifan yang cukup besar untuk terjadi tumbukan molekul gas itu, dengan adanya katalis heterogen, energi pengaktifan bisa diturunkan dan dicapai dengan lebih cepat. Reaksi antarmolekul gas melalui permukaan katalis melalui jalur reaksi yang berbeda dengan terbentuknya intermediate menyebabkan laju reaksi lebih cepat karena kesetimbangan terjadi lebih cepat pula tanpa mengubah termodinamika reaksi.
Urut-urutan dalam reaksi terkatalisis lebih jelas dapat disimak dalam skema reaksi di bawah ini, dengan R = reaktan, I`= intermediate, C = katalis, dan P = produk.
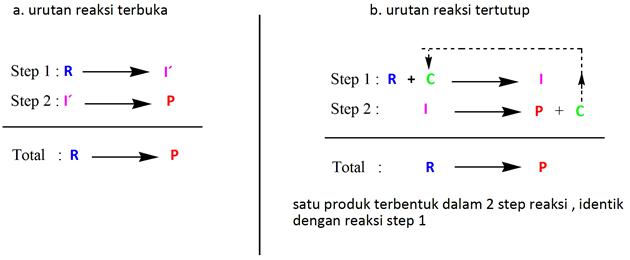 Sementara urutan reaksi secara stoikiometri (terbuka) maupun siklus reaksi terkatalisis (tertutup) diilustrasikan pada gambar di bawah ini. Secara jelas bisa kita lihat keterlibatan katalis dalam reaksi dan dihasilkan kembali pada akhir reaksi.
Sementara urutan reaksi secara stoikiometri (terbuka) maupun siklus reaksi terkatalisis (tertutup) diilustrasikan pada gambar di bawah ini. Secara jelas bisa kita lihat keterlibatan katalis dalam reaksi dan dihasilkan kembali pada akhir reaksi.

Katalis juga memainkan peran penting dalam produksi bahan bakar bersih, seperti hidrogen, yaitu bagaimana memproduksi energi menggunakan sel bahan bakar yang sangat efisien. Teknologi katalisis merupakan pusat pelaksanaan proses manufaktur dan inovasinya yang berkelanjutan menjadi lebih efisien dan lebih hijau dengan memanfaatkan bahan baku alternatif, seperti biomassa yang bersifat non-edible. Selain itu, bidang katalisis adalah bidang multidisiplin dan berisi insinyur dan ilmuwan dari kimia, ilmu material, fisika, biologi, dan biokimia sehingga menyediakan kesempatan untuk memecahkan banyak permasalahan fundamental dalam kehidupan.
Bahan bacaan:
Penulis:
Witri Wahyu Lestari, dosen kimia di UNS Solo, doktor bidang kimia anorganik dari Leipzig University, Jerman.
Kontak penulis: uwitwl(at)yahoo(dot)com.



