Logam adalah salah satu kelompok unsur yang sudah sangat lazim ditemui dalam kehidupan kita. Mulai dari alat tulis kantor, peralatan masak, peralatan elektronik, kendaraan, sampai bahan bangunan, semuanya menggunakan perangkat yang dibuat dengan bahan dasar logam. Sebut saja tembaga yang menjadi komponen dalam berbagai chip peralatan elektronik, ataupun besi yang menjadi bahan dasar baja. Saat ini, logam-logam yang ada kebanyakan telah dipadukan dengan logam lainnya untuk menghasilkan sebuah campuran logam yang disebut alloy. Logam-logam tersebut dicampur agar didapatkan sifat logam campuran yang sesuai dengan kebutuhan manusia.
Pernahkah kita bertanya dari mana logam tersebut berasal? Apakah langsung berbentuk seperti yang sedang kita gunakan sekarang? Ataukah berasal dari sebuah bongkahan logam yang tergeletak di padang pasir? Logam-logam yang kita gunakan sekarang adalah logam yang telah melalui berbagai proses sehingga berbentuk seperti yang kita gunakan saat ini. Mulai dari penambangan hingga pembentukan menjadi logam yang berguna dalam kehidupan kita sehari-hari. Semua hal tentang pemrosesan logam ini dikemas dalam salah satu cabang ilmu yang disebut metalurgi.
Dalam proses ekstraksi logam, ada satu atau lebih dari tiga tipe metalurgi berikut yang digunakan: (1) Pirometalurgi, yaitu proses yang menggunakan panas, (2) Elektrometalurgi, yaitu proses yang menggunakan langkah elektrokimia, dan (3) Hidrometalurgi, yaitu proses yang bergantung pada larutan kimia logam. Secara umum, proses ekstraksi dan pemanfaatan logam dimulai dengan penambangan.
Penambangan adalah proses atau kegiatan untuk mengambil bijih mineral langsung dari tempat asalnya. Penambangan bisa dilakukan secara tradisional seperti yang terdapat di beberapa daerah di Indonesia, atau bisa dilakukan dalam skala besar seperti yang dilakukan perusahaan-perusahaan penambangan semacam Aneka Tambang dan PT Timah. Hasil dari proses penambangan ini adalah bijih-bijih mineral yang di dalamnya terkandung unsur-unsur logam yang akan diproses nantinya, misalnya hematit yang dapat diolah menjadi besi.

Dalam bijih-bijih mineral, terkandung mineral-mineral yang dibutuhkan dan juga zat-zat yang tidak bernilai komersil seperti pasir, batu, serta tanah liat yang menempel pada mineral-mineral tersebut. Mineral sendiri didefinisikan sebagai kristal padat anorganik yang eksis di alam secara alami dan bersifat homogen. Oleh karena itu, hal yang perlu dilakukan selanjutnya adalah memisahkan mineral-mineral ini dari zat-zat non-komersil.
Proses pemisahan mineral banyak memanfaatkan perbedaan sifat fisik atau perbedaan sifat kimia dari mineral dengan zat non-komersil. Contohnya, untuk mineral magnetit ($latex {\rm Fe}_3{\rm O}_4$) yang bersifat magnet, pemisahan dapat dilakukan dengan menggunakan magnet untuk menarik mineral dan meninggalkan zat-zat non-komersil. Sementara itu, untuk mineral-mineral dengan perbedaan kerapatan terhadap zat-zat non-komersil yang cukup besar, proses pemisahan dapat dilakukan dengan cyclone separator. Pada cyclone separator, pemisahan terjadi dengan menggunakan udara tekanan tinggi melalui bijih-bijih mineral yang telah dihancurkan sebelumnya. Zat-zat non komersil akan terangkat dan dibuang keluar dari tabung, sedangkan mineral-mineral yang berat akan terjatuh.
Konversi menjadi senyawa lain
Setelah dipisahkan dari zat-zat non-komersil, mineral-mineral hasil pengolahan tersebut kemudian dikumpulkan. Proses selanjutnya adalah mengubah mineral-mineral ini menjadi unsur murni. Perlu satu atau beberapa tahap agar mineral benar-benar bisa diambil unsur logam murni yang dibutuhkan. Kebanyakan logam-logam di alam dalam bentuk mineralnya membentuk senyawa dengan unsur-unsur non-logam. Contohnya adalah timbal ($latex {\rm Pb}$) yang terdapat dalam bentuk mineral Galena ($latex {\rm PbS}$), kemudian ada pula besi ($latex {\rm Fe}$) yang terdapat di alam dalam bentuk mineral-mineral seperti Magnetit ($latex {\rm Fe}_3{\rm O}_4$) dan Hematit ($latex {\rm Fe}_2{\rm O}_3$).

Mineral-mineral yang ada di alam ini biasanya diubah dulu menjadi senyawa yang lain. Senyawa hasil konversi ini pada dasarnya memiliki sifat lebih mudah untuk direduksi, atau lebih bebas dari senyawa-senyawa pengotor. Biasanya konversi yang dilakukan adalah konversi menjadi bentuk oksida karena oksida lebih mudah direduksi. Sebagai contohnya, karbonat ($latex {\rm CaCO}_3$) diubah dengan pemanasan menjadi kalsium oksida ($latex {\rm CaO}$).
$latex {\rm CaCO}_3 (s) \xrightarrow{\Delta} {\rm CaO} (s) + {\rm CO}_2 (g)$
Contoh lainnya, senyawa sulfida logam seperti zink sulfida ($latex {\rm ZnS}$) diubah dengan pembakaran di udara menjadi zink oksida ($latex {\rm ZnO}$):
$latex 2{\rm ZnS} (s) + 3{\rm O}_2 (g) \xrightarrow{\Delta} 2{\rm ZnO} (s) + 2{\rm SO}_2 (g)$
Saat ini, metode hidrometalurgi telah banyak dipakai untuk menghindari pelepasan $latex {\rm SO}_2$ selama pembakaran. Contohnya pada pemrosesan tembaga, udara dimasukkan ke bubur $latex {\rm CuS}$ yang bersifat asam sehingga menghasilkan reaksi berikut:
$latex 2{\rm Cu}_2{\rm S} (s) + 5{\rm O}_2 (g) + 4{\rm H}^{+} (aq) \rightarrow 4{\rm Cu}^{2+} (aq) + 2{\rm SO}_4^{2-} (aq) + 2{\rm H}_2{\rm O} (l)$
Konversi menjadi unsur
Setelah mineral dikonversi menjadi senyawa yang lebih mudah diproses, tahap selanjutnya adalah mengubah senyawa tersebut menjadi unsur logam yang dibutuhkan. Metode yang lazim digunakan adalah reaksi reduksi-oksidasi. Metode ini menggunakan dasar tingkat potensial reduksi dari logam dengan zat lain. Dalam metode ini, senyawa logam direaksikan langsung dengan agen pereduksi (potensial reduksi lebih rendah) sehingga menghasilkan logam murni. Beberapa agen pereduksi yang umum adalah karbon dan hidrogen.
Dalam proses menggunakan karbon, karbon biasanya dihadirkan dalam bentuk kokas (residu dari pembakaran tidak sempurna batubara) atau arang. Oksida logam seperti zink oksida dilebur menggunakan panas bersama karbon untuk membebaskan logamnya seperti pada reaksi berikut:
$latex {\rm ZnO} (s) + {\rm C} (s) \rightarrow {\rm Zn}(g) + {\rm CO}_2 (g)$
Setelah logam diperoleh melalui proses ini, selanjutnya logam dikondensasi dan dipadatkan. Namun, tidak semua reaksi peleburan logam menggunakan satu tahap seperti reaksi di atas. Beberapa reaksi peleburan tersebut menggunakan beberapa langkah seperti pada reaksi peleburan timah(IV) oksida yang dimulai dengan tahap awal pembentukan timah(II) oksida:
$latex {\rm SnO}_2 (s) + {\rm C} (s) \rightarrow {\rm SnO} (s) + {\rm CO} (g)$
$latex {\rm SnO} (s) + {\rm C} (s) \rightarrow {\rm Sn} (l) + {\rm CO} (g)$
Reduksi dengan hidrogen dilakukan pada oksida logam yang reduksi dengan karbon justru menghasilkan karbida logam yang cenderung sulit untuk dikonversi lebih lanjut. Logam-logam jenis ini biasanya adalah logam pada grup 6B dan 7B. Contohnya adalah reaksi untuk menghasilkan tungsten (W) dan germanium (Ge) seperti berikut:
$latex {\rm WO}_3 (s) + {\rm 3H}_2 (g) \rightarrow {\rm W} (s) + 3{\rm H}_2{\rm O} (g)$
$latex {\rm GeO}_2 (s) + {\rm 2H}_2 (g) \rightarrow {\rm Ge} (s) + 2{\rm H}_2{\rm O} (g)$
Selain karbon dan hidrogen, proses konversi senyawa menjadi unsurnya juga dapat dilakukan dengan menggunakan logam yang lebih aktif. Logam yang lebih aktif adalah logam yang memiliki potensial reduksi lebih rendah daripada logam dalam senyawa yang akan dikonversi seperti pada reaksi untuk menghasilkan krom ($latex {\rm Cr}$) berikut ini:
$latex {\rm Cr}_2{\rm O}_3 (s) + 2{\rm Al} (s) \rightarrow 2{\rm Cr} (l) + {\rm Al}_2{\rm O}_3 (s)$
Selain dengan cara reduksi-oksidasi tersebut, juga dapat dilakukan cara reduksi-oksidasi elektrokimia. Dalam metode ini, mineral diubah menjadi elemen di dalam sebuah sel elektrolisis yang telah didesain secara khusus. Terkadang, mineral murni dalam bentuk lelehan halida atau oksidanya digunakan untuk menghindari reaksi samping yang tidak diinginkan. Logam akan diproduksi dari proses reduksi di katoda. Selain itu, sebuah separator juga digunakan dalam sel untuk mencegah rekombinasi. Metode ini digunakan dengan mempertimbangkan biaya prosesnya, terutama listrik yang digunakan. Voltase dan arus yang diperlukan bergantung pada potensial elektrokimia dari mineral yang dikonversi.
Pemurnian
Proses konversi dari mineral ke logam seringkali masih mengandung zat-zat pengotor yang mempengaruhi kemurnian dari logam itu sendiri. Oleh karena itu, setelah proses konversi, dilakukan proses pemurnian. Beberapa proses pemurnian yang terkenal adalah electrorefining, zone refining, dan destilasi.
Dalam electrorefining, logam yang tidak murni dijadikan sebagai anode dan sampel dari logam yang telah murni digunakan sebagai katoda pada sebuah sel elektrolisis. Nantinya logam yang tidak murni ini perlahan akan berpindah ke katode dan menempel pada logam yang telah murni. Proses destilasi digunakan untuk logam yang memiliki titik didih yang relatif rendah seperti Zink dan air raksa (Hg).
Pada proses zone refining, pengotor dihilangkan dari batangan logam yang tidak murni dengan mengkonsentrasikan pengotor-pengotor tersebut pada zona lelehan sedangkan logam yang telah dimurnikan direkristalisasi pada zona yang lain. Metaloid yang digunakan dalam semikonduktor elektronik seperti silikon (Si) dan germanium, harus dimurnikan dengan proses ini sehingga didapatkan kemurnian yang sangat tinggi.
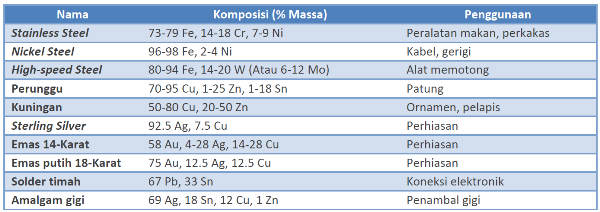
Pemurnian adalah proses final dari rangkaian proses ekstraksi logam. Namun, saat ini kebanyakan logam yang ada adalah paduan logam sehingga setelah dimurnikan biasanya logam-logam murni ini akan digabungkan dengan logam lainnya untuk membentuk suatu paduan logam yang disebut alloy. Memadukan logam dengan logam lainnya (pada beberapa kasus dengan non-logam) ditujukan untuk mengubah titik leleh dan meningkatkan sifat-sifat dari logam murninya, seperti konduktivitas dan kekuatan logam. Sebagai contoh, besi yang merupakan logam penting dalam kehidupan kita ternyata hanya digunakan setelah dipadukan dengan logam lain. Dalam bentuk murninya besi sangat lemah dan mudah terkorosi. Akan tetapi, jika dipadukan dengan karbon atau molibdenum (Mo), paduan besi ini menjadi sangat keras. Sementara itu, jika dipadukan dengan nikel (Ni) atau krom, besi menjadi resisten terhadap korosi.
Saat ini cukup banyak universitas yang membuka jurusan metalurgi secara khusus, baik di dalam negeri maupun di luar negeri. Di dalam negeri misalnya yang cukup terkenal ada di ITB, UI, dan ITS. Karena itu bagi teman-teman yang tertarik dengan jurusan metalurgi, ada baiknya dicari info lebih lanjut tentang bidang ini. Semoga bermanfaat.
Bahan bacaan:
- M. S. Silberberg, Chemistry: The Molecular Nature of Matter and Change, 5th ed., McGraw-Hill (2009).
- http://en.wikipedia.org/wiki/Metallurgy
- http://en.wikipedia.org/wiki/Ore
Penulis:
Ahmad Faiz Ibadurrahman, mahasiswa di JASSO Tokyo Japanese Language Education Center, Tokyo, Jepang. Kontak: ahmad21faiz(at)yahoo.com



