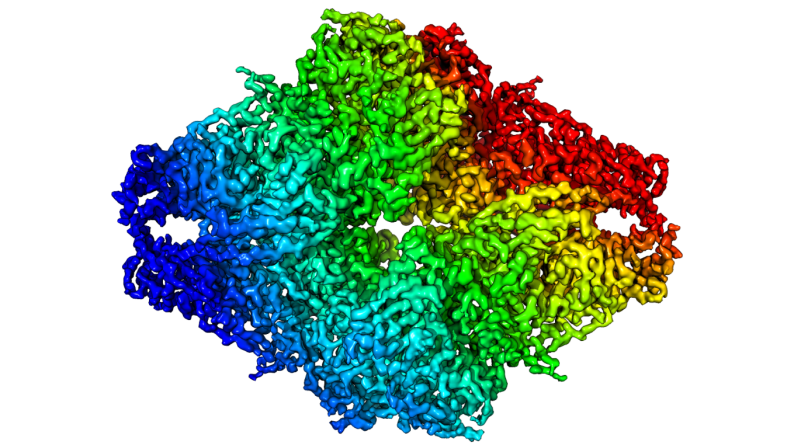
Setelah tiga tahun sebelumnya hadiah nobel bidang kimia diberikan kepada tiga ilmuwan atas kontribusi mereka dalam pengembangan mikroskop fluoresens resolusi tinggi, hadiah nobel kimia tahun ini kembali diberikan kepada tiga ilmuwan atas jasa mereka dalam pengembangan teknik pencitraan molekul. Jacques Dubochet, Joachim Frank, dan Richard Henderson, masing-masing berasal dari Swiss, Amerika (kelahiran Jerman), dan Inggris dianugerahi nobel bidang kimia 2017 atas kontribusi mereka dalam pengembangan teknik cryo-Electron Microscopy atau biasa disingkat cryo-EM untuk pencitraan biomolekul dengan resolusi tinggi.
Mungkin teman-teman banyak yang baru mendengar teknik mikroskopi yang satu ini. Pada dasarnya teknik ini menggunakan mikroskop elektron seperti pada umumnya, namun cara preparasi sampel dan cara pemrosesan gambar menjadi citra tiga dimensi utuhnya yang berbeda. Lalu apa yang membuat para pionir teknik ini diganjar hadiah nobel?

Sebelum cryo-EM dikembangkan, yang lebih banyak dipakai untuk pencitraan molekul (umumnya protein) adalah kristalografi x-ray yang dipadukan dengan data dari spektroskopi NMR (Nuclear Magnetic Resonance). Teknik-teknik ini memang bisa memberikan citra dari beberapa molekul dengan resolusi yang tinggi namun banyak keterbatasan mendasar yang membuat teknik ini tidak bisa dipakai untuk semua biomolekul. Kristalografi x-ray mengharuskan sampel diubah ke kristal (struktur teratur yang berulang) terlebih dahulu sedangkan tidak semua molekul dapat membentuk kristal. Spektroskopi NMR memang dapat memberikan informasi suplemen tentang struktur molekul dan bagaimana sebuah molekul berinteraksi dengan molekul lain, namun hanya protein dengan ukuran relatif kecil yang bisa dijadikan sampel.
Kisah teknik cryo-EM ini berawal dari Richard Henderson yang ketika mendapatkan gelar doktornya pada tahun 1960 menggunakan teknik kristalografi x-ray untuk mendapatkan citra protein. Berangkat dari hal tersebut ia menyadari banyaknya kekurangan yang harus ditutupi untuk mendapatkan gambar dengan resolusi tinggi dengan tetap mempertahankan keadaan asli biomolekul. Pada tahun 1970, setelah bertahun-tahun menemui banyak hambatan dengan kristalografi x-ray akhirnya ia beralih ke mikroskop elektron yang menggunakan electron beam (elektron yang dipercepat sehingga memiliki sifat seperti cahaya). Secara teori sinar elektron memiliki panjang gelombang lebih pendek daripada cahaya biasa sehingga mempunyai potensi untuk dapat memberikan resolusi yang tinggi hingga pada level atomik. Namun pada kenyataannya, elektron yang dibombardir ke sampel biomolekul dapat merusak sampel tersebut sehingga yang bisa dideteksi hanyalah molekul-molekul mati. Di sisi lain, menurunkan intensitas elektron akan menghasilkan citra yang kurang bagus dan cenderung kabur. Selain itu, karena mikroskop elektron bekerja dalam keadaan vakum, maka sampel biomolekul akan rusak karena air di sekelilingnya menguap sehingga biomolekul tidak berada pada bentuk aslinya.
Namun semua mulai menemui titik terangnya ketika Henderson menggunakan bakteriorodopsin sebagai sampel. Bakteriorodopsin adalah protein yang terdapat di membran organisme yang bisa berfotosintesis. Henderson dan timnya mencoba mengambil citra dari bakteriorodopsin tanpa mengeluarkannya dari membran asalnya. Untuk mencegah sampel dari kekeringan, mereka melapisi permukaan sampel dengan larutan glukosa. Setelah melalui banyak percobaan, pada tahun 1975 citra tiga dimensi bakteriorodopsin dari berbagai sudut pandang berhasil didapatkan. Pada masa tersebut, citra ini adalah yang terbaik untuk sebuah protein dengan resolusi sekitar 7 Å. Tidak merasa puas di titik ini, Henderson terus mencoba untuk menjadikan resolusi dari citra miliknya setara dengan citra molekul dari kristalografi x-ray yaitu sekitar 3 Å.
Pada percobaan yang dilakukan Henderson, ia dan timnya melapisi sampel bakteriorodopsin dengan larutan glukosa. Namun di sini terdapat sebuah masalah: biomolekul yang larut dalam air tidak bisa dijadikan sampel menggunakan metode ini. Para peneliti berusaha menggunakan cara lain yaitu dengan membekukan sampel karena es menguap lebih lambat daripada air. Namun yang terjadi adalah kristal es membuyarkan sinar elektron sehingga citra yang didapat sangat jauh dari ekspektasi. Di bagian inilah Jacques Dubochet berperan penting. Ia mempunyai ide untuk mengubah air menjadi padatan non-kristalin seperti kaca (vitrifikasi) sehingga sinar elektron dapat terurai sama rata dan menghasilkan latar yang seragam.
Pada tahap awal Dubochet dan timnya berusaha mengubah air menjadi padatan non-kristalin tersebut dengan cara membekukannya di nitrogen cair secara cepat sehingga tidak ada waktu bagi air untuk membentuk struktur kristal. Tahun 1982, ia dan timnya akhirnya berhasil mendapatkan air non-kristalin tersebut dengan menembakkannya ke etana yang telah didinginkan di nitrogen cair. Hal inilah yang menjadikan nama cryogenic (berhubungan dengan suhu rendah) disematkan pada teknik ini. Setelah itu mereka mengembangkan teknik tersebut sehingga bisa digunakan untuk sampel mikroskop elektron yaitu dengan cara meletakkan sampel yang sudah dilarutkan di air pada semacam saringan sehingga larutan sampel menjadi lapisan tipis di antara jaring-jaring yang kemudian saringan tersebut ditembakkan ke etana yang sudah didinginkan dengan nitrogen cair. Sekarang, alat untuk vitrifikasi sampel ini sudah dikemas ke dalam suatu mesin yang disebut vitrobot.

Lalu apa kontribusi Frank dalam pengembangan teknik cryo-EM ini? Setelah Henderson dan timnya berhasil mendapatkan citra tiga dimensi dari bakteriorodopsin yang pada keadaan asalnya memiliki arah yang seragam seperti pada gambar, para peneliti berpikir bagaimana agar metode ini dapat diterapkan untuk semua protein dan biomolekul terutama yang tersebar dengan arah tak menentu di dalam sampel. Teknik vitrifikasi yang dikembangkan Dubochet memungkinkan sampel dibekukan secara cepat sehingga biomolekul yang tersebar di dalam sampel tersebut menjadi beku dalam berbagai arah dan keadaan bahkan di tengah-tengah proses kerjanya. Hal ini memungkinkan citra dua dimensi sebuah biomolekul diambil dari berbagai sudut pandang. Joachim Frank dan timnya mengembangkan sebuah algoritma yang memungkinkan untuk mengombinasikan citra-citra dua dimensi dari berbagai sudut pandang tersebut sehingga menghasilkan sebuah citra utuh tiga dimensi.
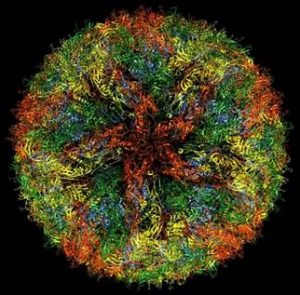
Meski semua serpihan dari teknik cryo-EM ini sudah terkumpul, pada masa awalnya citra biomolekul yang dihasilkan dari cryo-EM sangat jauh dari resolusi yang bisa diberikan kristalografi x-ray. Bahkan, pada tahun 1991 ketika Frank berusaha mengambil citra tiga dimensi ribosom, ia hanya mendapatkan kontur kasar yang beresolusi sekitar 40 Å, sangat jauh dari resolusi kristalografi x-ray. Namun seiring dengan perkembangan mikroskop elektron, teknik cryo-EM ini juga semakin berkembang dan semakin banyak protein maupun biomolekul lain yang bisa diabadikan citra strukturnya dalam level atomik. Beberapa di antaranya adalah kapsid virus Zika, ribosom, dan ribuan protein di dalam tubuh organisme.
Diawali oleh Henderson dan bakteriorodopsinnya, kemudian disempurnakan oleh Dubochet dengan metode vitrifikasi air dan Frank dengan algoritma penggabungan citra dua dimensinya, mereka bertiga berhasil mengembangkan teknik cryo-EM sehingga bisa digunakan untuk mendapatkan citra biomolekul dengan resolusi atomik. Hal ini membawa perubahan besar bagi dunia sains hayati karena akhirnya banyak protein dan biomolekul lain yang sebelumnya tidak terbayang bagaimana bentuk dan detilnya, menjadi bisa dilihat dalam resolusi atomik yang semakin meningkat seiring berjalannya waktu. Padahal pada awalnya, pencitraan biomolekul dengan mikroskop elektron banyak dipandang sebelah mata oleh ilmuwan-ilmuwan lain. Demikianlah, kerja keras dan keuletan dari ketiga ilmuwan ini merevolusi dunia pencitraan biomolekul sehingga membawa banyak manfaat bagi banyak ilmuwan lainnya. Terutama Henderson, yang selalu berpikir positif bahwa mikroskop elektron akan terus berkembang sampai bisa memberikan citra level atomik dari biomolekul.
Bahan bacaan:
- https://www.nobelprize.org/nobel_prizes/chemistry/laureates/2017/popular-chemistryprize2017.pdf
- https://www.fei.com/products/vitrobot/
- http://www.nature.com/news/the-revolution-will-not-be-crystallized-a-new-method-sweeps-through-structural-biology-1.18335
Penulis:
Ahmad Faiz Ibdr., Mahasiswa di Osaka University.
Kontak: ahmad21faiz(at)yahoo(dot)com.