Dalam kehidupan sehari-hari, seringkali kita menemui berbagai peralatan yang terbuat dari logam. Kita menggunakan kekuatan dan ketajaman pisau untuk memotong daging, panci aluminium untuk merebus air, dan kabel untuk menghubungkan kulkas kita pada sumber listrik sehingga menjaga makanan yang tersimpan di dalamnya. Tahukah kamu bagaimana cara menjelaskan sifat-sifat yang terdapat pada material macam ini? Mari kita menelusuri rahasia logam dalam pembahasan yang sederhana.
Logam disusun oleh atom-atom yang terhubung rapat dengan ikatan logam. Akan tetapi, logam hanya tersusun oleh atom-atom elektropositif yang serupa, yang cenderung mengionisasi elektron valensinya sendiri. Ketika banyak elektron terbebaskan, mereka akan terdelokalisasi dan membentuk lautan elektron. Lautan elektron ini bermuatan negatif, sedangkan nukleon bermuatan positif. Oleh sebab itu, keduanya berinteraksi dengan gaya Coulomb dan membuat ikatan logam sangat kuat.
Model lautan elektron juga dapat menjelaskan sifat logam yang dapat ditempa. Misalkan kita memukul sebuah blok metal menggunakan palu. Kita dapat membayangkan atom-atom dalam blok tersebut akan terdorong ke dalam, akan tetapi lautan elektron sangat fleksibel dan elastis. Lautan elektron akan menjaga atom-atom agar tidak terpisah satu sama lain. Jika kita bandingkan dengan material lain seperti garam yang merupakan senyawa ion atau kayu yang tidak memiliki susunan atom yang teratur, material-material tersebut akan hancur ketika dipukul karena interaksi antaratomnya tidak dapat dipertahankan.
Untuk menjelaskan model lautan elektron, kita perlu menjelajahi pula teori pita energi. Namun, sebelum itu, kita mesti mengetahui teori orbital molekuler. Sederhananya, orbital molekuler adalah orbital yang dihasilkan dari interaksi orbital atom yang saling tumpang tindih. Elektron-elektron yang menetap di orbital atom akan mengisi orbital molekuler mengikuti aturan Hund. Diiringi prinsip larangan Pauli, tidak ada dua elektron yang dapat memiliki bilangan kuantum yang sama dalam satu molekul. Jadi, jika dua atom identik bersatu untuk membentuk sebuah molekul, dua orbital ini akan terbagi menjadi dua orbital molekuler dengan energi yang berbeda agar elektron-elektron tersebut dapat menempati struktur orbital yang baru tanpa melanggar larangan Pauli.

Di dalam logam, terdapat atom identik yang sedemikian banyaknya sejumlah bilangan Avogadro yang memiliki orbital atom yang tumpang tindih. Kira-kira 6×1023 atom per mol di dalam logam tersusun rapat membentuk kisi-kisi tertentu. Perbedaan energi antartingkat orbital molekuler yang berbeda itu sedemikian dekatnya sehingga dapat dianggap sebagai suatu rentang energi yang kontinu, atau bisa disebut sebagai pita energi, seperti ditunjukkan pada gambar.
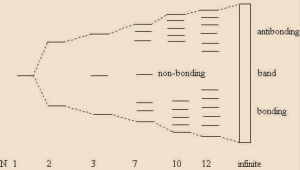
Setelah terbentuk pita energi, elektron-elektron akan menempati orbital “ikatan” yang disebut sebagai “pita valensi”. Orbital yang tidak terisi adalah orbital “antiikatan” yang kini disebut sebagai “pita konduksi”. Pita konduksi ini berperan penting dalam proses “konduksi” pada logam. Di dalam material logam, pita valensi dan pita konduksi diketahui saling bersentuhan dan kontinu. Dengan kata lain, tidak ada “celah” di antara keduanya. Tidak dibutuhkan energi untuk memindahkan elektron dari pita valensi ke pita konduksi sehingga material logam sangat mudah menghantarkan listrik.
Berlawanan dengan konduktor logam, pada kasus insulator kita memiliki kisi-kisi yang orbital atomnya sudah penuh. Dengan demikian, orbital ikatan maupun antiikatan pada susunan orbital molekuler insulator pun terisi penuh, menghasilkan pita valensi yang terisi penuh pula, yang berjarak sangat jauh dengan pita konduksi. Celah energi yang besar itu menyebabkan insulator tidak dapat menghantarkan listrik pada kondisi normal. Namun, jika celah energinya cukup kecil dan dapat dicapai dengan sejumlah energi eksternal, kita bisa memperoleh sesuatu yang disebut sebagai semikonduktor, yang kerap digunakan pada berbagai peralatan elektronik.
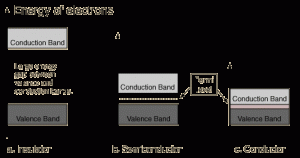
Perlu diperhatikan bahwa proses penghantaran listrik pada logam masih harus berhadapan dengan hambatan listrik. Hambatan ini menyia-nyiakan sebagian energi menjadi panas sehingga ada inefisiensi transfer energi. Hingga saat ini ada banyak upaya para ilmuwan untuk mengurangi hambatan listrik hingga nol supaya transfer energi listrik sangat efisien. Material yang dapat menghantarkan listrik (nyaris) tanpa hambatan dikenal sebagai superkonduktor. Sayangnya, material ini harus beroperasi pada suhu yang sangat rendah, misalnya sekitar –200oC, yang didinginkan menggunakan nitrogen cair. Mudah-mudahan saja di masa depan nanti kita bisa menggunakan superkonduktor pada suhu ruangan.
Bahan bacaan:
- Crash Chemistry Academy. Metallic Bonding and Metallic Properties Explained: Electron Sea Model.
- https://en.wikipedia.org/wiki/Electronic_band_structure
Penulis:
Alwan Abdillah Darussalam, mahasiswa S-1 di Jurusan Kimia Molekuler, Tohoku University, Jepang.
Kontak: ads.alwan(at)gmail(dot)com.



