Kimia koordinasi sempat menjadi salah satu bab dalam pelajaran kimia yang paling dihindari oleh penulis pada tahun 2010 saat duduk di bangku Sekolah Menengah Atas (SMA). Senyawa yang terlalu rumit dan kurangnya pemahaman dalam membaca dengan baik adalah beberapa faktor yang menyebabkan kimia koordinasi tidak disukai saat itu. Di era masa kini, pengembangan soal mengenai kimia koordinasi telah banyak diulas, contohnya di ajang Olimpiade Sains Nasional Kimia. Oleh karena itu, siswa-siswi dituntut untuk memahami kimia koordinasi selangkah lebih maju.
Di balik rumitnya senyawa koordinasi, ternyata terdapat beberapa filosofi yang sangat mudah untuk dipahami. Kerumitan hanyalah sebuah pengembangan dari prinsip dasar yang sudah ada. Di sini, penulis akan memberikan pemahaman singkat mengenai hal tersebut.
Pertama, kadang kala seorang kimiawan tidak dapat membedakan pengertian senyawa koordinasi dan senyawa kompleks secara umum. Senyawa koordinasi adalah senyawa kompleks, akan tetapi senyawa kompleks belum tentu senyawa koordinasi. Senyawa koordinasi adalah senyawa yang tersusun atas 3 spesies atau lebih dengan keberadaan atom pusat yang berfungsi sebagai penentu bentuk geometri.
Spesies itu sendiri dapat berupa kation, anion, atau senyawa netral. Misalkan, [PtCl4]2- sebagai senyawa anti kanker, terdiri dari 5 spesies, yaitu 1 spesies Pt4+ yang dapat disebut atom pusat atau kation dan 4 spesies Cl– yang dapat disebut sebagai ligan atau anion. Di sisi lain, senyawa kompleks adalah senyawa yang terdiri dari 3 spesies atau lebih, akan tetapi tidak ada atom pusat sebagai penentu geometri molekul. Contohnya, FeSO4∙7H2O adalah senyawa dasar dalam pembuatan magnet yang terdiri dari 9 spesies, yaitu: 1 spesies Fe sebagai kation, 1 spesies SO42- sebagai anion, dan 7 spesies H2O sebagai hidrat atau spesies bermuatan netral.
Jika ditelaah lebih lanjut pada senyawa koordinasi, antara atom pusat dan ligan-ligan akan berikatan secara kovalen koordinasi dengan bentuk geometri tertentu. Sementara itu, senyawa komplek hanya berikatan secara ionik dan tidak memiliki bentuk geometri.
![Struktur senyawa koordinasi [PtCl4]2-. Gambar dari: chemtube3d.com.](http://majalah1000guru.net/wp-content/uploads/Ed61-kimia-1.jpg)
Kedua, jika kita tinjau senyawa koordinasi lebih dalam, teori asam-basa Lewis memiliki peranan yang sangat vital. Spesies dikatakan sebagai asam Lewis ketika suatu spesies memiliki orbital kosong yang dapat terisi oleh Pasangan Elektron Bebas (PEB), sedangkan spesies dikatakan sebagai basa Lewis jika dapat mendonorkan setidaknya satu PEB dalam senyawanya.
Senyawa koordinasi memiliki kestabilan tinggi apabila asam Lewis memiliki banyak orbital kosong, didukung dengan basa Lewis yang memiliki banyak PEB. Umumnya, spesies asam Lewis berasal dari logam golongan transisi 3d karena logam tersebut memiliki orbital beberapa kosong pada kulit 3d. Apabila orbital 3d seluruhnya terisi oleh elektron, kulit keempat (4s, 4p, 4d, dan 4f) dapat menampung PEB tersebut mengingat tingkat energi antara 3d dan 4s tidak terlampau cukup jauh.
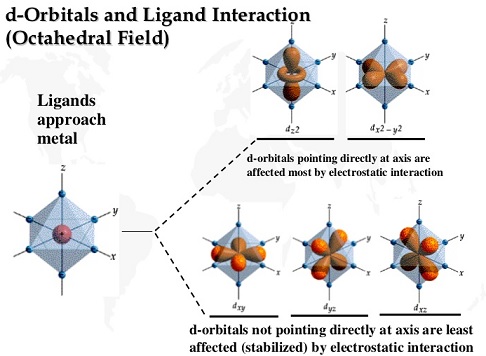
Ketiga, fenomena yang terjadi dalam atom pusat umumnya sulit untuk dipahami dengan jelas. Kulit pada orbital d memiliki 5 subkulit yang dibagi menjadi dua kelompok berdasarkan ketepatan posisi sumbu x, y, dan z-nya.
Kelompok 1 adalah subkulit yang tepat berada pada sumbu, maka subkulit akan menerima sepasang elektron bebas dari ligan. Definisi subkulit itu sendiri adalah daerah probabilitas tertinggi ditemukannya elektron, sedangkan ligan juga akan mendonorkan PEB. Pada saat fenomena ini, energi yang dibutuhkan akan menjadi lebih tinggi karena dibutuhkan kekuatan yang lebih untuk mengikat elektron dari ligan pada orbital atom pusat.
Meskipun atom pusat memiliki beberapa subkulit yang kosong, kadang kala elektron pada subkulit yang lain dapat berpindah-pindah posisi. Dengan demikian subkulit yang secara teoritis dikatakan kosong, kenyataannya tidak benar-benar kosong. Menurut penamaan teori simetri dan poin grup, kelompok 1 dikenal sebagai orbital eg.
Kelompok 2 berkebalikan dengan kelompok 1. Dengan kata lain, ketika ligan datang dengan PEB, subkulit tersebut tidak secara langsung berhadapan dan terpengaruh oleh PEB, malah energinya menjadi lebih rendah. Kelompok 2 ini disebut orbital t2g. Hal yang perlu digarisbawahi adalah geometri oktahedral merupakan acuan utama dalam pembagian tersebut. Jika nantinya terdapat senyawa komplek dengan bentuk geometri yang lain, misalnya segi empat planar (pada senyawa PtCl42-), tetrahedral, planar dan lainnya, dapat dilakukan beberapa modifikasi untuk menentukan pembagian kelompok dengan sebutan yang berbeda pula.
Keempat, kestabilan senyawa kompleks bergantung pada jenis ligan yang diikat oleh atom pusat. Kekuatan ligan diukur dari kemampuannya untuk mendonorkan PEB. Jika spesies mengandung gugus dengan keelektronegatifan yang tinggi, kemampuan mendonorkan PEB-nya menjadi semakin rendah, misalnya senyawa dengan ligan :C-(CH3)3 dan :C-(CF3)3. Tentu saja :C-(CF3)3 merupakan ligan yang lebih lemah dari :C-(CH3)3 karena atom F memiliki nilai keelektronegatifan yang tinggi dibandingkan dengan atom H. Jangankan didonorkan, elektron di sekitar atom pusat justru bisa ditarik juga ke arah atom F. Jika meninjau pada kekuatan ligan, hal tersebut sangat berhubungan erat dengan “Deret Spektrokimia”.
Deret Spektrokimia adalah suatu deret yang menyatakan urutan kekuatan ligan yang dikemas sederhana. Untuk mengetahui kekuatan ligan, reaksi kimia dapat digunakan sebagai salah satu metodenya. Misalkan, ada sebuah ion Fe3+ yang akan direaksikan dengan ligan kloroda (Cl–) maupun tiosulfat (NCS–). Ligan NCS– secara spektrokimia lebih kuat dibandingkan dengan ligan Cl–. Maka, reaksi kimianya adalah sebagai berikut:
Fe3+ + 6Cl–→ [FeCl6]3- (berwarna kuning)
[FeCl6]3- + NCS–→ [Fe(SCN)6]3- (berwarna merah)
Ligan NCS– berhasil menggantikan ligan Cl– dalam kompleksnya. Sementara itu, jika ligan tersebut dibalik, reaksi kimianya sebagai berikut:
[FeCl6]3- + NCS–→ [Fe(SCN)6]3-
[Fe(SCN)6]3- + 6Cl–→ tidak bereaksi
Ligan Cl– tidak mampu untuk menggantikan ligan NCS– yang notabene lebih kuat darinya. Perubahan kimia secara kualitatif dapat dilihat dari perubahan warna dan pelepasan panas. Peningkatan suhu menandakan energi kompleks baru lebih stabil dibandingkan kompleks sebelumnya, dan kelebihannya dilepaskan sebagai panas.
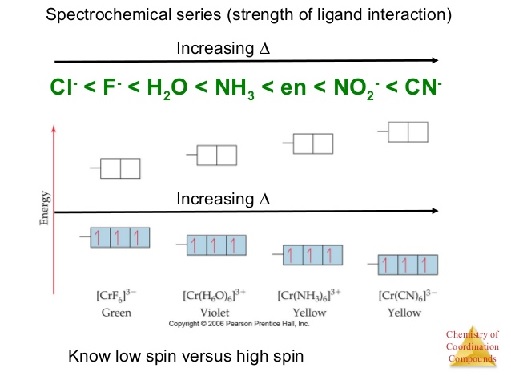
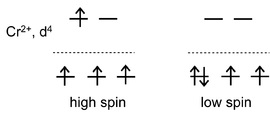
Kelima, keberadaan ligan pada kompleks yang telah dibahas pada poin keempat sebelumnya, ternyata menyebabkan pengisian elektron yang berbeda pada konfigurasi orbital d, yang telah terbagi menjadi 2 kelompok pada poin ketiga. Perbedaan kekuatan ligan terbagi menjadi dua kelompok, yaitu ligan lemah dan ligan kuat. Perbedaan antara keduanya akan diilustrasikan secara sederhana di bawah ini.
Bayangkan subkulit orbital d telah terpecah menjadi dua kelompok (perhatikan lagi gambar pembagian orbital d menjadi kelompok eg dan t2g). Jika terdapat empat buah elektron, kita dapat menuliskan konfigurasinya, yaitu 3 elektron berada pada orbital t2g dan masing-masing subkulit memiliki 1 elektron dengan arah spin yang sama. Nah, bagaimanakah dengan elektron keempat?
Elektron keempat memiliki 2 kemungkinan. Pertama, mengisi salah sub kulit t2g yang telah terisi masing-masing 1 elektron. Kedua, elektron keempat mengisi orbital eg. Jika pilihan kedua dipilih, elektron keempat akan memiliki gaya tolak elektrostatik dengan elektron yang telah mengisi orbital t2g. Tolakan ini tidak dapat dihindarkan walaupun pengisian elektron keempat memiliki arah spin yang berbeda.
Bagaimanapun juga, elektron bermuatan negatif, yang jika saling bertemu akan menimbulkan adanya gaya tolak. Gaya tolak tersebut dinotasikan dengan Gaya Pasangan (P) atau dalam bahasa Inggris dikenal sebagai Pairing Force. Jika pilihan pertama dipilih, sejumlah energi dibutuhkan untuk mengeksitasi elektron keempat dari sub kulit t2g menuju eg. Energi ini biasa dinotasikan dengan Δ atau Dq. Nilai 1Δ setara dengan 10 Dq. Kesimpulannya, jika nilai P > Δ, ligan yang terikat dikatakan sebagai ligan kuat, dan sebaliknya jika nilai P < Δ, ligan yang terikat dikatakan sebagai ligan lemah.
Bahan bacaan:
- http://www.chemtube3d.com/gallery/structurepages/PtCl42-.html
- https://en.wikibooks.org/wiki/Introduction_to_Inorganic_Chemistry/Coordination_Chemistry_and_Crystal_Field_Theory
- http://www.slideshare.net/RawatDAGreatt/coordination-chemistry
Penulis:
Benny Wahyudianto, alumnus S1 Jurusan Kimia, FMIPA, Universitas Gadjah Mada.
Kontak: benny.wahyudianto(at)mail.ugm.ac.id