Siapa yang tidak tahu kembang api? Kembang api banyak dijual saat menyambut perayaan-perayaan khusus, seperti pada acara perayaan tahun baru. Ledakan cahaya di langit sangat menarik untuk dilihat. Warnanya yang bermacam-macam menghiasi langit malam. Namun, tahukah teman-teman, kembang api menggunakan ilmu kimia sebagai dasar dari warna-warna indah yang bermunculan di angkasa?
Setiap warna yang muncul saat kembang api meledak di udara dihasilkan oleh campuran bahan kimia tertentu, yang umumnya mengandung senyawa logam transisi (transition metal compound). Misalnya, warna putih didapatkan dari pembakaran logam titanium (Ti) atau magnesium (Mg), sedangkan warna merah didapatkan dari garam stronsium (Sr), seperti stronsium nitrat/Sr(NO3) dan stronsium karbonat (SrCO3). Apabila kita melihat warna biru, itu adalah hasil pembakaran garam tembaga (Cu). Untuk mendapatkan warna ungu, kita cukup mencampurkan garam stronsium yang menghasilkan warna merah dengan garam tembaga yang menghasilkan warna biru. Menarik, bukan?

Bagaimana caranya garam logam yang umumnya berupa bubuk yang tidak menarik mampu menghasilkan warna-warna yang begitu cantik? Untuk menjelaskannya, diperlukan ilmu dasar dari kimia. Ingat lagi bahwa atom terdiri atas nukleus, yakni inti atom, yang terdiri atas proton dan neutron, dan dikelilingi oleh elektron. Nah, elektron-elektron yang mengelilingi nukleus itu hanya dapat ditemukan di daerah-daerah khusus yang disebut orbital.
Meskipun tidak terlalu akurat, secara kasar kita dapat memahami pergerakan nukleus dan elektronnya dengan membayangkan tata surya kita. Nukleus dapat diibaratkan sebagai matahari yang dikelilingi oleh elektron-elektron yang bergerak seperti planet di orbit yang tetap. Setiap orbit memiliki energi tertentu yang nilainya pasti. Orbit yang jaraknya lebih dekat dengan inti atom memiliki energi yang lebih kecil dibandingkan orbit yang jaraknya lebih jauh.
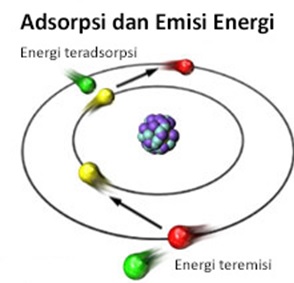
Elektron dapat berubah posisi orbitnya apabila menyerap atau melepaskan energi. Apabila elektron pindah ke orbit yang lebih jauh dari orbit asalnya, elektron harus menyerap energi yang sesuai untuk memenuhi besar energi minimum yang dibutuhkan untuk menempati orbit tersebut. Sebaliknya, ketika elektron berpindah ke orbit yang lebih dekat dengan inti atom, elektron akan melepaskan perbedaan energi dalam bentuk paket energi atau foton.
Apa hubungannya dengan warna kembang api? Ketika kembang api diledakkan di angkasa, panas yang muncul dari hasil pembakaran memberikan energi bagi elektron-elektron di atom logam transisi. Energi yang disediakan dari panas pembakaran bermacam-macam, tetapi ketika besar energi yang tepat tersedia bagi elektron-elektron di atom tersebut, elektron akan segera berpindah ke orbital yang lebih jauh. Dalam kimia, proses ini disebut eksitasi. Setelah tereksitasi, elektron akan berusaha menempati orbital dengan energi yang terendah agar stabil. Oleh karena itu, elektron yang tereksitasi melepaskan kelebihan energinya dalam bentuk foton.

Foton yang dilepaskan oleh elektron-elektron inilah yang menjadi sumber warna yang kita lihat saat kembang api diledakkan. Besarnya paket energi yang dikeluarkan setiap logam itu berbeda-beda. Karena energi terhubung dengan frekuensi dan panjang gelombang, besarnya energi dapat menentukan warna apa yang kita lihat. Uniknya, karena paket energi yang dilepaskan oleh elektron untuk setiap logam berbeda-beda, warna pembakaran garam logam transisi dapat juga digunakan untuk mengidentifikasi senyawa logam yang digunakan. Dengan kata lain, warna pembakaran tersebut menjadi semacam sidik jari yang khas bagi setiap senyawa logam transisi.
Tidak percaya? Coba buktikan sendiri di rumah dengan percobaan yang sederhana. Ambil sedikit garam dapur dan bakar dengan api, akan terlihat semburan warna kuning yang menyala dari kandungan natrium di garam dapur. Warna ini sama dengan warna lampu jalan dan juga kembang api yang menggunakan natrium.
Menarik, bukan? Sekarang, apabila teman-teman sedang menonton kembang api, sudah mengerti dong proses di balik warna-warni ledakan kembang api tersebut dan bisa menjelaskannya ke teman-teman yang lain.
Bahan bacaan:
Penulis:
Ivan Adiyasa Thiodorus, mahasiswa di Chemical and Biological Engineering Department, Nagoya University, Jepang. Kontak: thiodorus.ivan(at)gmail.com.



