Teman-teman pasti sudah sering melihat atau bahkan melakukan percobaan reaksi kimia di laboratorium sekolah. Tentunya, saat melakukan percobaan tersebut dibutuhkan bahan-bahan kimia yang sudah tersedia, baik itu di dalam botol tertutup ataupun dalam bentuk padatan maupun cairan.
Jika teman-teman memperhatikan pada botol-botol yang berisi bahan kimia tersebut terdapat label yang berisi data-data bahan kimia di dalamnya, misalnya titik didih, sifat bahan, dan tingkat kemurnian. Selain itu, pada label tersebut juga tertera nama perusahaan yang memproduksinya.
Mari berpikir sejenak. Jika bahan kimia ini diproduksi oleh sebuah perusahaan, apakah perusahaan tersebut memproduksi bahan kimia ini sebagaimana percobaan yang kita lakukan di laboratorium? Kalau seperti itu, berapa lama waktu yang dibutuhkan untuk memproduksi satu botol zat kimia dan berapa lama waktu yang dibutuhkan untuk memproduksi ratusan botol dengan zat yang sama?
Tentu jawabannya tidaklah sama antara produksi zat pada skala laboratorium dan skala masif/industri. Itulah sebabnya, saat ini kita mengeenal cabang ilmu teknik yang disebut dengan teknik kimia. Singkatnya, salah satu tujuan dari ilmu ini adalah bagaimana agar produksi sebuah zat kimia dapat dilakukan pada skala besar secara efektif dan efisien.
Mari kita ambil contoh sebuah zat kimia yang sudah tidak asing lagi bagi kita semua, asam sulfat (H2SO4). Zat kimia ini digunakan sebagai bahan dasar dalam banyak industri seperti industri pupuk dan baterai. Asam sulfat adalah salah satu zat kimia yang paling penting mengingat penggunaannya yang sangat luas. Saat ini produksi asam sulfat dilakukan dalam skala sangat masif dan mencapai lebih dari 150 ton per tahun.
Pembuatan asam sulfat telah dimulai sejak 400 tahun yang lalu. Ketika itu, asam sulfat diperoleh dari distilasi green vitriol (FeSO4.7H2O). Di zaman sekarang, produksi asam sulfat dilakukan dengan cara yang lebih modern, yaitu dengan proses kontak. Pada proses ini dilakukan 4 langkah utama, yaitu:
1. Proses pengambilan belerang mentah
Umumnya belerang mentah diperoleh dari wujud gas dan padatannya. Namun, belerang lebih melimpah dalam wujud padat yang tersimpan di bawah tanah sehingga belerang lebih banyak diambil dari wujud padatnya. Untuk mengambil belerang dari bawah tanah ini proses yang umum digunakan adalah proses Frasch.
Proses Frasch adalah proses nonkimia menggunakan air bersuhu tinggi (sekitar 160 oC) untuk melelehkan belerang di bawah tanah. Belerang yang sudah meleleh tersebut lalu dipompa dan akan terangkat ke permukaan melalui pipa yang telah dirancang sedemikian rupa.
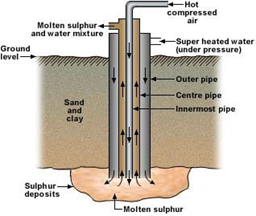
2. Proses dari belerang menjadi sulfur dioksida
Belerang mentah yang telah dikeluarkan dari tanah selanjutnya akan diproses lagi sehingga menjadi sulfur dioksida (SO2). Pada proses ini, belerang mentah akan dioksidasi sesuai reaksi berikut:
$latex \mathrm{S}_8 (s) + \mathrm{O}_2 (g) \rightarrow \mathrm{SO}_2 (g); \quad \Delta H^\circ = -297~\mathrm{kJ}$
3. Proses dari sulfur dioksida menjadi sulfur trioksida
Pada proses ini, sulfur dioksida yang telah didapat akan dioksidasi lagi menjadi sulfur trioksida menurut reaksi berikut:
Akan tetapi, reaksi ini berjalan lambat pada temperatur ruangan. Untuk mengatasinya, cara yang mungkin digunakan adalah dengan meningkatkan temperatur sehingga tumbukan antara sulfur dioksida dan oksigen menjadi lebih cepat.
Seperti yang ditunjukkan pada persamaan reaksi di atas, reaksi antara sulfur dioksida dan oksigen adalah reaksi eksotermik. Sesuai prinsip Le Chattelier, menurunkan suhu akan menggeser reaksi ke arah kanan (SO3). Di sinilah peran katalis dibutuhkan untuk menurunkan energi aktivasi sehingga kesetimbangan dapat dicapai lebih cepat meski pada kondisi temperatur lebih rendah. Katalis yang biasa dipakai adalah V2O5 dalam silika inert.
$latex \mathrm{SO}_2 (g) + \frac{1}{2} \mathrm{O}_2 (g) \leftrightarrow \mathrm{SO}_3 (g) \Delta H^\circ = -99~\mathrm{kJ}$
4. Proses dari sulfur trioksida menjadi asam sulfat
Untuk mengubah sulfur trioksida menjadi asam sulfat, langkah-langkah reaksi yang umum dilakukan adalah sebagai berikut:
$latex \mathrm{SO}_3 (g) + \mathrm{H}_2\mathrm{O} (l) \rightarrow \mathrm{H}_2\mathrm{SO}_4 (l)$
$latex \mathrm{SO}_3 (g) + \mathrm{H}_2\mathrm{SO}_4 (l) \rightarrow \mathrm{H}_2 \mathrm{S}_2 \mathrm{O}_7 (l)$
$latex \mathrm{H}_2\mathrm{S}_2\mathrm{O}_7 (l) + \mathrm{H}_2\mathrm{O} (l) \rightarrow 2 \mathrm{H}_2\mathrm{SO}_4 (l)$
Reaksi-reaksi tersebut dilakukan karena penambahan sulfur trioksida langsung ke dalam air menghasilkan jumlah produk yang rendah. Hal ini disebabkan pembentukan polimer (SO3)x yang dikatalisasi oleh uap air. Polimer ini berinteraksi buruk dengan air sehingga menghasilkan jumlah produk asam sulfat yang rendah. Untuk itu, asam sulfat yang telah didapat sebelumnya direaksikan dengan sulfur trioksida dan menghasilkan asam pirosulfat (H2S2O7) yang kemudian dihidrolisis menjadi asam sulfat.
Selain proses pembuatan asam sulfat, masih banyak proses pembuatan zat-zat kimia lain dalam skala industri yang menarik untuk dipelajari. Jika ada dari teman-teman yang tertarik mempelajari tentang pembuatan bahan-bahan kimia dalam skala industri, mungkin dapat melajutkan kuliahnya ke jurusan teknik kimia. Di jurusan ini, selain pembuatan zat-zat kimia, juga dipelajari proses produksi bahan-bahan kimia seperti deterjen, obat, pupuk, dan masih banyak lagi proses zat lainnya.
Bahan bacaan:
- Silberberg, Martin S., Chemistry: The Molecular Nature of Matter and Change, 5th, McGraw-Hill (2009).
- http://en.wikipedia.org/wiki/Contact_process
- http://en.wikipedia.org/wiki/Frasch_process
Penulis:
Ahmad Faiz Ibadurrahman, mahasiswa National Institute of Technology, Wakayama College, Jepang.
Kontak: ahmad21faiz(at)yahoo(dot)com.



