Saat ini baterai menjadi barang yang tidak bisa dilepaskan dalam kehidupan kita sehari-hari. HP, digital kamera, laptop, bahkan robot dan mobil, semuanya memerlukan baterai sebagai sumber penggerak. Baterai akan menjadi salah satu sumber energi masa depan yang sangat menjanjikan.
Di antara banyak jenis baterai, baterai litium-ion mendapat perhatian utama. Selain memiliki kepadatan energi yang tinggi, baterai ini juga ringan, dan bisa dipakai berkali-kali.

Baterai litium-ion, pertama kali dikembangkan oleh ilmuwan Jepang, Yoshino Akira, yang memadukan karbon, litium dan polimer sebagai anode. Pada tahun 1991, untuk pertama kalinya baterai litium-ion diproduksi secara massal oleh Sony Corp. berkerja sama dengan Asahi Kasei Corp. Sejak saat itu, baterai litium-ion terus berkembang pesat dan pada tahun 2010 baterai litium-ion mulai digunakan pada mobil, lebih dikenal dengan nama mobil hybrid atau mobil elektrik.
Prinsip kerja dari baterai Litium-ion
Tabel di bawah memperlihatkan perbandingan 3 jenis baterai, yaitu fuel cells, baterai nikel-metal hydrida dan baterai litium-ion, yang menjadi fokus tulisan ini. Ketiga jenis baterai ini memiliki kesamaan, yaitu memanfaatkan reaksi redoks (reduksi dan oksidasi) pada kedua elektrode untuk menghasilkan listrik.
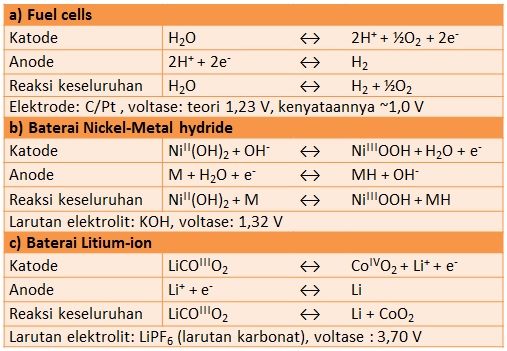
(sumber: Chemistry Today 2009, vol. 463, hal. 20).
Fuel cells memanfaatkan reaksi antara hydrogen dan oksigen untuk menghasilkan listrik. Tegangan yang dihasilkan secara teoretis sebesar 1,23 V, namun pada kenyataannya hanya di bawah 1,0 V. Berbeda dengan fuel cell, baterai nikel-metal hydrida menggunakan material penyimpan hidrogen sebagai anode dan nikel hidroksida sebagai katode. Baterai ini mampu menghasilkan tegangan 1,32 V.
Di antara ketiga jenis baterai ini, baterai litium-ion menghasilkan tegangan tertinggi, 3 kali lipat dari yang dihasilkan baterai nikel-metal hydrida. Baterai litium menggunakan komposit berstruktur lapisan, Litium Cobalt Oxide ($latex {\rm LiCoO}_2$) sebagai katoda, serta material karbon (dengan litium disisipkan di antara lapisan karbon) sebagai anode.
Susunan struktur dari baterai litium-ion bisa dilihat pada gambar di bawah. Baterai litium-ion terdiri atas anode, separator/pemisah, elektrolit, dan katode. Katode dan anode umumnya terdiri atas 2 bagian, yaitu bagian material aktif (tempat masuk-keluarnya ion litium) dan bagian pengumpul elektron (current collector).
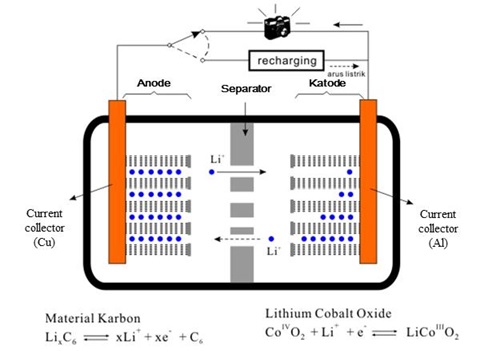
(sumber: Chemistry Today 2009, vol. 463, hal. 21, dengan perubahan).
Proses penghasilan listrik pada baterai litium-ion dapat dijelaskan sebagai berikut. Ketika anode dan katode dihubungkan, elektron akan mengalir dari anode menuju katode. Bersamaan dengan itu, arus listrik mengalir pada arah sebaliknya. Pada bagian dalam baterai, terjadi proses pelepasan ion litium pada anode, kemudian ion tersebut berpindah menuju katode melalui larutan elektrolit. Dalam katode, bilangan oksidasi kobalt berubah dari 4 menjadi 3 karena masuknya elektron dan ion litium dari anode. Sementara itu, proses recharging/pengisian ulang, terjadi berkebalikan dengan proses penghasilan listrik.
Dari sekian banyak jenis logam, mungkin kita akan bertanya kenapa litium dijadikan sebagai bahan anode? Alasannya, litium memiliki nilai potensial standar paling negatif (-3,0 V), paling ringan (berat atom: 6,94 g) sehingga bila digunakan sebagai anode dapat menghasilkan energi yang tinggi.
Berikut ini cara menghitung nilai kepadatan energi yang dihasilkan oleh baterai litium-ion secara teoretis. Jika menggunakan logam litium pada anode, maka dari 1 kg logam litium dapat dihasilkan kapasitas energi per 1 kg massa sebesar (Coulumb/second = Ampere):
$latex \displaystyle = \frac{96500~{\rm C/mol}}{3600~{\rm s/hour}} \times \frac{1000~{\rm gr/kg}}{6,94~{\rm gr/mol}} = 3861~{\rm Ah/kg}$
Bila dikalikan dengan potensial standar litium (3 V), kepadatan energi menjadi 11583 Wh/kg (W=Watt, h=hours). Sementara itu, bila menggunakan senyawa karbon sebagai anode, dan dianggap satu unit grafit ( 6 atom karbon) mampu menampung 1 atom litium, setiap 1 kg anode secara teoretis akan memiliki kepasitas energi sebesar 339 Ah/kg.
Seperti halnya pada anode, kapasitas energi pada katode bisa dihitung dengan cara yang sama. Untuk $latex {\rm LiCoO}_2$, secara teoretis kapasitas energinya 137 Ah/kg. Dengan mengetahui berat molekul dari material elektrode (disebut juga material aktif) dan berapa banyak elektron yang keluar masuk di setiap molekulnya, kapasitas dan kepadatan energi baterai litium selalu dapat dihitung.
Bahan bacaan:
- D. Aurbach dkk, Electrochim. Acta 2002, 47, 1423-1439.
- H. Kim, B. Han, J. Choo, dan J. Cho, Angew. Chem. Int. Ed. 2008, 47, 10151 –10154.
- W. M. Zhang dkk, Adv. Mater. 2008, 20, 1160–1165.
- J. Huang dan Z. Jiyang, Electrochim. Acta 2008, 53, 7756-7759.
Penulis:
Dedy Eka Priyanto, pegawai IHI Corporation, Jepang. Kontak: dedlier(at)yahoo(dot)com.



